1.目的
金属イオンが有機試薬との錯形成反応によって難溶性の錯体を生成することを利用した重量分析法を学ぶ。今回の実験ではニッケル鋼中のニッケルとのジメチルグリオキシムとの錯体形成を利用した定量分析を行った。実験を通し、正確な重量の測定と目的化学種を選択的に沈殿させて、濾過による分離操作、電気乾燥器などによる過熱操作などによって、単離、秤量形にする基礎操作を習得する。
2.実験操作
(A)ガラスフィルターの恒量化
(i)電気乾燥器に入っているガラスフィルターを取り出し、1分間の空冷し、デシケーター中で30分間冷却させた。
(ii)冷却が終了後、精密電子天秤でガラスフィルターを秤量した。この時、直接手でフィルターに触れず、るつぼバサミを用いて精密電子天秤の載台にのせた。
(iii)同様にして、電気乾燥器で30分間の乾燥させた後に、1分間空冷させてからデシケーター中で再び30分間冷却させた。
(iv)再度精密電子天秤を用いてガラスフィルターを秤量し、前回とのガラスフィルターの重量差が0.3mg以内となった。よって、ガラスフィルターの恒量化が終了した。
(B)ニッケルの定量
(i)ニッケル鋼の切削約0.5gを50mlビーカーに取り、精密電子天秤で精秤した。その後、量り取ったニッケル鋼を500mlビーカーに移した。
(ii)500mlビーカーをドラフトに運び、濃塩酸20mlを駒込ピペットで加えて、ニッケル鋼を溶かした。気泡の発生が弱くなったので、ホットプレートで加熱してニッケル鋼を完全に溶かした。
(iii)濃硝酸10mlを駒込ピペットで少量ずつ加えて、再びホットプレートで加熱沸騰させてNO2を追い出した。褐色の気体(NO2)が出なくなったので、ホットプレート上から下ろした
(iv)液体をイオン交換水でおよそ200mlに希釈し、酒石酸約3gを加えて、再度ホットプレート上であたためて溶解させた。
(v)冷却後に6Mアンモニア溶液を駒込ピペットで少量ずつ加えて中和し、さらに1ml過剰に加えた(中和操作はpHメーターを用いた)。溶液のかき混ぜに用いたガラス棒やpHメーターの電極についた溶液もイオン交換水で洗い、これもアンモニア溶液を加えたビーカーに入れた。
(vi)全溶液に6M塩酸を駒込ピペットで少量ずつ加えて酸性にする(pH4前後の酸性にpHメーターで調節した)。
(vii)酸性にした溶液の入ったビーカーを、ドラフト中のホットプレート上でおよそ70℃に加熱し、1%ジメチルグリオキシム・エタノール溶液を駒込ピペットで20mlを少しずつ攪拌しながら加えていった。
(viii)6Mアンモニア溶液を試料溶液が弱アルカリ性になるまで加え、ニッケルジメチルグリオキシムを沈殿させた。20〜30分間ホットプレート上でビーカーに時計皿をかぶせ、穏やかに加熱放置した(70度以下)。
(ix)恒量にしたガラスフィルターで、沈殿を吸引濾過した。濾液にニッケルジメチルグリオキシムが確認されたので、アンモニア溶液を加えて約70℃にホットプレート上で再加熱し、再び先ほどにガラスフィルターを用いて吸引ろ過をした。ろ液にジメチルグリオキシム・エタノール溶液を4〜5滴加えて、沈殿が生じないことを確認した。
(x)この沈殿を100ml程度の熱湯で洗った。最後のろ液の一部を時計皿(小)に採り、硝酸銀溶液を加えてCl−イオンが無いことを確認した。
(xi)ガラスフィルターの水を切った後、ガラスフィルターを電気乾燥器中110〜120℃で40分乾燥させた。2回目以降は、加熱時間を30分、空冷1分、冷却30分にして秤量を恒量になるまで繰り返した。測定前後の誤差が0.3mg以下だったので、次の操作に移った。
(xii)恒量操作が終了したあと、ニッケルジメチルグリオキシムの沈殿の入ったガラスフィルターは、ガラスフィルター用のビンにいれ、実験台の上にわかるようにおいておいた。
3.実験結果
(1)ガラスフィルターの恒量
実験操作(A)でのガラスフィルターの恒量化の結果を下記の表に示す。
表1 ガラスフィルターの恒量化
|
秤量回数 |
秤量測定値 (g) |
|
1回目 |
36.1679 |
|
2回目 |
36.1681 |
前後の恒量値の差は0.2mgで誤差0.3mg以内にある。よって、2回目の秤量結果を恒量値となり、ガラスフィルターの恒量重量は36.1681(g)である。
(2)ニッケルジメチルグリオキシムの重量
(i)ニッケル鋼の採取試料重量
ニッケル鋼の採取時、ビーカーをのせて天秤の0合わせを行った。すなわち、計り取った値はニッケル鋼の採取量である。
ニッケル鋼の採取量 0.4997 (g)
(ii)ガラスフィルター+ニッケルジメチルグリオキシムの重量
実験操作(B)の(xi)での、ガラスフィルターでろ過し際にニッケルジメチルグリオキシムが残った量を乾燥させて、恒量化した測定結果を下記に示す。
表2 ニッケル錯体とガラスフィルターの恒量化
|
秤量回数 |
秤量測定値 (g) |
|
1回目 |
36.2267 |
|
2回目 |
36.2269 |
前後の恒量値の差は0.2mgで誤差0.3mg以内にある。よって、2回目の秤量結果を恒量値となり、ガラスフィルターの恒量重量は36.2269(g)である。
(iii)生成ニッケルジメチルグリオキシムの重量
上記の結果から、ニッケルジメチルグリオキシムの重量は(2)(ii)の恒量値から(1)の恒量値を引けば算出できる。よって、ニッケルジメチルグリオキシムの重量は、
36.2269ー36.1681=0.0588 (g)
となり、0.0588(g)と算出できた。
(3)ニッケル鋼中のニッケルの含有量
ニッケルジメチルグリオキシムの化学式はC8H14O4N4Niと与え与えたれているので、原子量が有効数字4桁を用いて算出したニッケルジメチルグリオキシムの分子量は288.922である。また、Niの原子量は58.69である。(2)より、ニッケル鋼0.4997(g)からニッケルジメチルグリオキシム0.0588(g)が生成したことになる。よって、ニッケル鋼0.4997(g)中のニッケルの含有量は、
![]()
となり、0.01992 (g)と算出できた。
また、ニッケル鋼中のニッケルの含有率は、
![]()
とわかる。
4.考察
(1)ニッケル含有率の表示値2.92%との比較
今回の実験での含有率は2.39%で、表示値2.92%大きく離れた値となった。今回の実験での絶対誤差と相対誤差を算出する。
絶対誤差 2.38−2.92=−0.54 (%)
相対誤差 0.54/2.92×100=18.49=18.5 (%)
となり、大きな誤差があることがわかる。
上記の結果を踏まえて考察をする。今回の実験でまずニッケルを多く損失したと考えたれる操作は、ニッケルジメチルグリオキシムをガラスフィルターで吸引ろ過をしたときである。ろ液にニッケルジメチルグリオキシムが流れ出たことが実験中に観察され再度吸引ろ過を行った。2回目の吸引ろ過後のろ液の方が、1回目に比べてろ液のにごりは無くなったのもの、まだろ液はにごっておりニッケルジメチルグリオキシムが存在しているのがはっきりと確認できた。この原因は、吸引ろ過器の減圧力が強くガラスフィルター上の微細なニッケルジメチルグリオキシムがガラスフィルターを通り抜けてしまったためだと考えられる。
また、酸を加えてニッケル鋼を溶かす際に、ニッケル鋼がビーカーの内壁に付着した分が完全に溶けなかったために、ニッケルジメチルグリオキシムを形成できなかった事が考えられる。
上記の2つが表示値と実測値が大きく異なってしまった原因ではないかと考えれる。
(2)各操作過程の理由
○(B)(ii)ニッケル鋼に濃塩酸を加え、ホットプレートで加熱した。
ニッケルを強酸である塩酸と反応させて、Ni2+として溶かすため。
○
(B)(iii)濃硝酸を加えた。
ニッケル鋼中には鉄が含まれている鉄もFe2+として塩酸を加えた時点で溶けている。Fe2+もジメチルグリオキシムと錯体を形成してしまうので、Fe3+に酸化するための酸化剤として硝酸を加えた。
○(B)(iv),(v)酒石酸を加え、加熱。その後6Mアンモニア溶液を加え、弱アルカリ性にした。
弱塩基下から塩基かではFe3+水酸化鉄を形成して沈殿してしまう。これを防ぐために、塩基性でもFe3+と安定な錯体を形成する酒石酸を添加した。そのため、アンモニア溶液を加える前に、酒石酸を添加したのである。水酸化鉄として沈殿していけない理由は、ジメチルグリオキシムを沈殿として析出させろ過して採取するためである。
○(B)(vi)〜(viii)6M塩酸を加えて酸性にし、1%ジメチルグリオキシム・エタノール溶液を加える。その後、6Mアンモニア溶液を加え、弱アルカリ性にする。
ニッケルジメチルグリオキシムは弱塩基で沈殿を生成する。塩基性下でジメチルグリオキシム・エタノール溶液を加えると、一気に沈殿を生じてしまい微細な沈殿が形成します。これではろ過の際にろ液に流れてしまう。そのため、一度酸性にしてアンモニア溶液を加えいく事により、沈殿の成長が緩やかで大きな沈殿ができ、ろ過の際に沈殿がろ液に流れにくくなる。
○(B)(ix)吸引ろ過し、1%ジメチルグリオキシム・エタノール溶液を4〜5滴加え、沈殿が生じないことを確認。
ニッケルジメチルグリオキシムの沈殿生成反応が完結しているかの判断をするためである。
○(B)(x)沈殿を熱湯で洗った後、ろ液に硝酸銀溶液を加え、Cl−がないことを確かめる。
沈殿を洗浄し、イオン性の不純物を除去するため。はじめに塩酸を加えたので、大部分の不純物が塩化物となっている可能性が高いので、硝酸銀溶液を用いてCl−の検出を行った。
5.課題
塩化銀AgClを例にとって説明する。
(1)沈殿の生成と溶解度との関係について
イオン性の固体の化合物はある点まで溶けて、そこで飽和して、それ以上溶けない。この溶液が飽和溶液で、この時の濃度が溶解度である。飽和溶液と過剰に存在する固体は平衡状態にある。塩化銀の場合には、
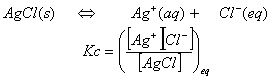
となる。固体の濃度は一定であるから、[AgCl]をKcの中に含める事が出来る。ここで、残った量を溶解度積Kspとして表す。
![]()
一般的に、解離すればx個の陽イオンMm+とy個の陰イオンAa-ができる塩MxAyの溶解度積は、次のように表す事が出来る。
![]()
溶解度はとは、MxAyだけがどれだけ解ける事が出来るかを表すものであり。Kspから容易に算出できる。Kspは温度のみの関数で物質固有の定数である。
Kspは飽和溶液中に存在できるM+とX−の最大濃度を規定した数値といえる。いま、二液を混合した瞬間を考えてみると、両イオンの濃度の積とその塩のKspとの大小関係から、次のようなことがいえる。
![]() ・・・・ 沈殿が生成する。
・・・・ 沈殿が生成する。
![]() ・・・・ 沈殿が生じない。
・・・・ 沈殿が生じない。
溶液中で両イオンの濃度の積が、溶解度積に達すると沈殿を生じはじめ、それを超過した分だけ沈殿となる。また、溶解度積の小さい塩ほど、溶液中に存在しうるイオン濃度が小さい。よって溶解度の小さいものから順に沈殿してくる。
(2)溶解度に対する共通イオンの影響
(1)で述べたように、溶解度積は電離したときのイオンの積である。例えば、すでに塩化銀で飽和している溶液に、塩ナトリウムを加えたらどうなるかは、ルシャトリエの原理を適用すればできる。すなわち、難溶解塩の方が沈殿する。すなわち、溶解度が共通イオンのために低下する。これが共通イオン効果である。結論は溶解度積の式から導く事ができる。
6.参考文献
玉虫文一ら編集:理化学事典 第3版増補版,岩波書店,1986
H.FREISER著:分析化学 −理論と計算−,東京化学同人,1994
阿部光雄編著:基礎化学選書20 分析化学実験,裳華房,1986