1.目的
鎮痛解熱剤として古くから用いられているアスピリン(アセチルサリチル酸)の合成を通して、アルコールと酸無水物の反応によるアシル化の触媒の働きや、再結晶などの分離精製操作について学ぶ。
2.実験器具
実験に用いた実験器具について示す。
表1 実験器具
|
品名 |
規格 |
数量 |
品名 |
規格 |
数量 |
|
三角フラスコ |
50ml |
4 |
薬さじ |
|
1 |
|
試験管 |
|
3 |
ブッフナー |
|
1 |
|
試験管立て |
|
1 |
吸引瓶 |
|
1 |
|
温度計 |
100℃ |
3 |
|
|
|
3.試薬・薬品
まず、今回のアセチルサリチル酸の合成で用いる試薬と精製物の試薬の構造について示す。
サリチル酸(salicylic acid)
m.p.=157〜157℃ ,b.p.=211℃(20mmHg) ,m.w.=138.12
無色の針状で、冷水に少し溶ける。電離定数1.1×10-3。腐食剤として用いられ、誘導体にも医薬に供されるものが少なくない。
アセチルサリチル酸(acetylsalicylic acid)
m.p.=135℃ ,m.w.=180.16
臭気のある固体で無色から白色である。弱酸を示し、140℃以上で分解する。解熱,鎮痛,消炎作用があるアスピリンの名称で解熱鎮痛薬に利用されている。
ピリジン(pyridine)
m.p.=-38℃ ,b.p.=115℃ ,m.w.=79.10
刺激性の異臭ある無色の揮発性液体。コールタールまたは骨油などから得る。塩基性。溶剤やアルコールの変性剤に用いる。
無水酢酸(acetic anhydride)
m.p.=-73℃ ,b.p.=129℃ ,m.w.=102.09 ,比重1.084
無色刺激臭の液体、皮膚をおかす。医薬・染料・香料などの重要な合成原料。火災,爆発の危険あり。
濃硫酸(concentrated sulfuric acid)
通常90%以上の濃度の硫酸を示す。硫酸は常温では無色の液体で、濃度の高いものは油状。酸性が強く、水に混ぜると多量の熱を出す。脱水作用がある。
酢酸ナトリウム(sodium acetate)
m.p.=324℃ ,m.w.=82.03 ,d=1.528(g/cm3)
無水和物は単斜晶系片状の結晶塊、緩衝剤として分析試薬、写真用、染料の媒染などに用いられる。
酢酸エチル(ethyl acetate)
m.p.=-83℃ ,b.p.=77℃ ,m.w.=88.11 ,比重0.901
芳香のある無色の液体。高濃度の蒸気を吸入すると中毒を起こすおそれがある。
ヘキサン(hexane)
m.p.=-100〜-95℃ ,b.p.=69℃ ,m.w.=88.11 ,比重0.660 ,引火点-63℃
600〜700℃で分解し、水素、メタン、エチレンを生ずる芳香のある無色の液体。
3.実験手順
1日目
(1)触媒による反応速度の違い
○硫酸触媒
(i)試験管にサリチル酸1.00gをはかりとり、これに無水酢酸2mlを加えた。
(ii)濃硫酸5滴を加えて温度計でかき混ぜ様子を観察し、温度と時間の関係を記録した。(5分間、30秒刻みで)
○ピリジン触媒
(i)硫酸触媒時と同じように、試験管にサリチル酸1.00gをはかりとり、これに無水酢酸2mlを加えた。
(ii)ピリジン5滴を加え、温度計でかき混ぜ様子を観察し、温度と時間の関係を記録した。(15分間、1分刻みで)
○酢酸ナトリウム触媒
(i)硫酸触媒時と同じように、試験管にサリチル酸1.00gをはかりとり、これに無水酢酸2mlを加えた。
(ii)無水酢酸ナトリウム0.2gを加えて温度計でかき混ぜ様子を観察し、温度と時間の関係を記録した。(1時間、最初の10分は2分ごとで後は10分ごと)
(2)粗製アセチルサリチル酸の採取
(i)ピリジンを触媒に用いた試験管を5分間、100℃の浴槽に入れて反応を完結させた。
(ii)試験管の内容物を、12.5mlの水を入れた30ml三角フラスコに移して、三角フラスコの内壁をこすって結晶化させた。
(iii)なかなか析出しなかったので氷冷した。
(iv)吸引ろ過して粗製アセチルサリチル酸結晶を得た。
(v)吸引ろ過で得た紙箱に移して、静置乾燥させた。
2日目
○アセチルサリチル酸の精製と融点測定
(i)1日目に合成したアセチルサリチル酸の粗製の収量を測定した。
(ii)融点測定用に極少量を残し、50ml三角フラスコに入れ、10mlの酢酸エチルを加えた。よく攪拌しても結晶がすべて溶けなかったので、酢酸エチルを2.5ml追加して結晶をすべて溶解させた。
(iii)この三角フラスコに15mlのヘキサンを加え、氷冷し、析出する結晶の様子を記録した。
(iv)結晶を吸引ろ過して目的物を得た。
(v)粗製と精製したアセチルサリチル酸の融点を各2回ずつ測定した。
3.結果
(1)各触媒でのアセチル化の様子
○硫酸触媒
表2 硫酸触媒での温度による温度変化
|
時間 t (sec) |
温度T (℃) |
時間 t (sec) |
温度 T (℃) |
|
0 |
16.5 |
210 |
35.2 |
|
30 |
29.0 |
240 |
34.9 |
|
60 |
26.0 |
270 |
33.2 |
|
90 |
24.0 |
300 |
32.1 |
|
120 |
25.0 |
330 |
31.1 |
|
150 |
29.0 |
360 |
29.9 |
|
180 |
33.8 |
|
|
表2を基にして、グラフを作成した。
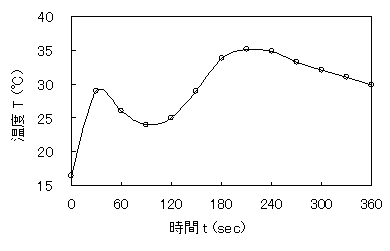
図1 硫酸触媒での温度による温度変化
1分ほど経つ白い結晶固体がなくなり、透明な溶液になった。3分ぐらいから白い結晶が析出しだした。
○ピリジン触媒
表3 ピリジン触媒での温度による温度変化
|
時間 t (min) |
温度T (℃) |
時間 t (min) |
温度T (℃) |
|
0 |
16.0 |
8 |
22.9 |
|
1 |
19.2 |
9 |
22.0 |
|
2 |
22.0 |
10 |
21.2 |
|
3 |
22.0 |
11 |
20.8 |
|
4 |
22.8 |
12 |
20.1 |
|
5 |
22.8 |
13 |
20.0 |
|
6 |
23.0 |
14 |
19.8 |
|
7 |
23.1 |
15 |
20.0 |
表3を基にして、グラフを作成した。
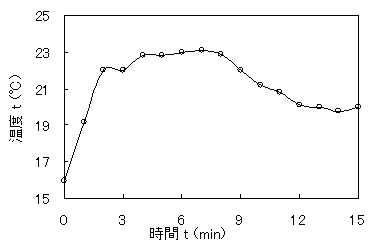
図2 ピリジン触媒による触媒での温度による温度変化
1分を過ぎたころからサリチル酸が溶け始め、8分には完全に溶けた。12分に試験管の内壁を温度計で擦る白い結晶が析出し始めた。
○酢酸ナトリウム触媒
表4 酢酸ナトリウム触媒での温度による温度変化
|
時間 t (min) |
温度T (℃) |
時間 t (min) |
温度T (℃) |
|
0 |
17.0 |
20 |
18.0 |
|
2 |
16.8 |
30 |
19.2 |
|
4 |
17.1 |
40 |
19.2 |
|
8 |
17.2 |
50 |
19.0 |
|
10 |
17.8 |
60 |
20.0 |
表4を基にして、グラフを作成した。
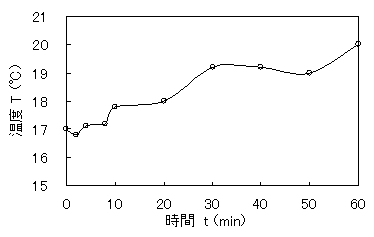
図3 酢酸ナトリウム触媒での温度による温度変化
2分ぐらいで少し溶けて、4分ぐらいで再び白い沈殿が増え始めた。6分ぐらいから20分ぐらいにかけて白い沈殿の量が減り、30分には完全に透明の溶液になった。40分ぐらいから白い沈殿が析出し始めて60分までの間に量がドロドロした白色結晶が完全に析出した。
(2)融点測定
融点測定で測定された、粗製と生成のアセチルサリチル酸の溶け始めと溶け終わりの温度を下記の表にまとめた。
表5 融点測定
|
|
粗製 |
精製 |
||
|
|
溶け始め温度(℃) |
溶け終わり温度(℃) |
溶け始め温度(℃) |
溶け終わり温度(℃) |
|
1回目 |
121.8 |
122.9 |
132.5 |
133.0 |
|
2回目 |
123.2 |
125.0 |
135.3 |
137.7 |
融点に達し結晶が溶け始めると、すぐに全体が溶け、白く濁っていたかと思うと透明の液体に変化した。これが分解による変化が、融点直後の温度で起こるためだと思う。
(3)収率
ピリジン触媒でアセチルサリチル酸を合成したときの各試料物質量を下記の量に示す。また、サリチル酸と無水酢酸は下記の反応式のように、1対1の反応でサリチル酸を生成する。

表6 試薬の物質量
|
|
無水酢酸 |
サリチル酸 |
|
比重 |
1.084 |
ー |
|
採取量 |
2ml |
1.00g |
|
分子量 |
102.09 |
138.12 |
|
物質量 |
0.0212 |
0.00724 |
上記の表より、サリチル酸が限定反応物質であることがわかる。ここでピリジンを無視したのは、この反応ではピリジンは触媒としてだけ関与するからである。
限定反応物質がわかったことにより、今回行った反応の収率が算出できる。アセチルサリチル酸の理論収量は、限定反応物質のサリチル酸の物質量にアセチルサリチル酸の分子量をかけてやればいいので、
0.00724×180.16=1.304=1.30 (g)
1.30(g)である。下記の表7の収率は、採取できた結晶すべてがアセチルサリチル酸と仮定して、結晶の重さ(収量)を理論収量で割った値を百分率で算出した。
表7 収量と収率
|
|
箱 (g) |
箱+結晶 (g) |
結晶 (g) |
収率 (%) |
|
粗製 |
1.18 |
2.15 |
0.97 |
74.6 |
|
精製 |
1.22 |
1.88 |
0.66 |
50.8 |
4.考察
まず、粗製の収率が約75%と悪くなってしまった理由を考える。温度を測定時に、きちんと攪拌できておらず、反応物質同士が接触できずに反応を終了させてしまった。これは、時間と反応温度の図を見てもわかるように、ピリジン触媒のときだけ温度がほぼ一定になっている時間の割合が長い事から予想した。また、吸引ろ過を行った際に、ろ紙から完全にアセチルサリチル酸を取ることができなかったことも大きな原因だと考えられる。
また、粗製から精製への段階で大きく下がった。粗製物に副生成物や未反応のサリチル酸が多く残ってしまっていた事が考えられる。反応時に攪拌少なかったので、ピリジンとサリチル酸が中和反応を起こしてしまったと考えられる。さらに、再結晶する際に粗製物が完全に酢酸エチル10mlで完全に溶解しなかったので、+2.5ml加えた事により酢酸エチルに溶解したアセチルサリチル酸が増えてしまった事が大きな原因だと考えられる。もう1つ大きな原因と考えられるのは、ろ過する際に三角フラスコ内壁に付いていた結晶をすべて取れなかったことである。
精製物の融点は文献地に近く、粗製物の融点とも約10℃高かった。精製の操作できちんと不純物を除く事ができたと考えられる。しかし、精製物の融点範囲が文献値の融点135℃を超えてしまっているので少しおかしい気もする。この原因は、温度計の測定部と試料の測定部の温度が異なっていたためだと思う。2つの距離が離れていた事に起因すると考えられる。また、文献値の融点よりも高くなってしまった測定管には、大量にアセチルサリチル酸を入れてしまったことの原因だと考えられる。
精製のアセチルサリチル酸の結晶は、繊維状の白くて細い結晶だった。放冷時間が短く、すぐに氷冷してしまったために飽和度が大きくなってしまったため、結晶が大きく成長せずに結晶化してしまったためだと考えられる。ゆっくり結晶化させれば、文献通りの針状晶がえられたのではないだろうか。粗製物の結晶は顆粒状の結晶で、精製物の結晶とはまったく結晶形が異なっていた。
5.課題
硫酸触媒によるアセチル化反応の機構

6.参考文献
フィーザー著:フィーザー 基礎有機化学,丸善,1974
フィーザー著:フィーザー 有機化学実験,丸善,1980
J.マクマリー著:マクマリー 有機化学概論,東京化学同人,2000
玉虫文一ら編集:理化学事典 第3版増補版,岩波書店,1986
http://themerckindex.cambridgesoft.com/ マルク インデックス ウェブ編