�P�D�ړI
�@�@�@��F���͂Ƌz�����x�@�́A���ʐ�����v�����m�ɒ�ʂ���̂ɗp��������@�ł���B�ߔN�Z�p�̐i���ɂ��A��F���͂͂قƂ�Njz�����x�@�ő��肷��悤�ɂȂ��Ă���B�z�����x�@�͕��q��C�I���̉��w��̌��̋z�������𗘗p���āA�ړI�����̔Z�x�Ȃǂ��ʂ�����@�ł���B
����̎����ł͔�r�I�ȒP�Ȍ��x�v���g�p���āA���n�t����Fe2+���ʂ���BFe2+��2,2�f-dipyridyl�Ɣ������ĐԐF�̈���ȍ��������B�����̋z���X�y�N�g����œK����(���g��g����)�ȂǂׁA���x�v�̑�����K�����A���쌴���𗝉����ăn���o�[�g�E�x�[���̖@����p���ċz���x��z���萔���Z�o����B
�Q�D��������
�@�@�@���������ɐ[����������Ă���@���ALambert(Bouguer)-Beer�̖@���ɂ��ċL�q����BLambert(Bouguer)-Beer�@���́ALambert(Bouguer)�̖@����Beer�̖@����g�ݍ��킹�ē��o�����B
�@�@��Lambert(Bouguer)�̖@���F���ˌ����n���ɂ���ċz������銄���͗n���w�̌���L�ɔ��B����������ʉ߂���Ƃ��A���ˌ��̋��xI0�Ɠ��ߌ��̋��xlt �̔�(l0 �^It)�̑ΐ��͗n�t�w(�����w)�̌���L�ɔ�Ⴗ��B
log(l0 �^It) ��a�fL
(a�f�͔��萔)
��Beer�̖@���F���ˌ����n���ɂ���ċz������銄���͗n���̔Z�xc �ɔ�Ⴗ��B����������ʉ߂���Ƃ��A���ˌ��̋��xI0�Ɠ��ߌ��̋��xlt �̔�(l0 �^It)�����n�t�w(�����w)�̔Z�xc �ɔ�Ⴗ��B
log(l0 �^It) ��a�hc�@�@�@�@�@(a�h�͔��萔)
���@����g������ƁA
log(I0 �^lt ) ����c L�@�@�@�@(�Â͔��萔)
�ƁALambert(Bouguer)-Beer �̖@�������o�ł���Bc �������Z�x�̎��A�Â̓����z���W���ł���B�z���x[-]�C�z���x[-]�C�����z���x�����ꂼ��T�C�`�C�ƒ�`����ƈȉ��̂悤�ɂȂ�B
�@�@�s �� It �^l0
�@�@�` �� log (�P�^�s) ���|log (�s) ��log(I0 �^lt ) ����c L
�@�@�� �� �` �^cL
�R�D��������
�@(�`)���x�v�̎g�p���@�ƃZ���
�@(�P)���x�v�̎g�p���@
�@�@(i)���x�v�̃X�C�b�`�����A20�`30���҂��Ă��瑪�肷��g���̃t�B���^�[�𑪌����ɍ��킹��B
�@�@(ii)�ŏ��ɐ��������ꂽ�Z�������H��̃Z���z���_�[�ɓ���A���x���߂܂݂��ĂO�����킹�����A�V���b�^�[���J���P�O�O�����킹������B
�@�@(iii)�Z���z���_�[�̃n���h������O�Ɉ����A�����n�t�̓������Z�������H�ɓ���B�O�����킹�����āA�V���b�^�[���J�����[�^�[�̂ӂ�(���ߗ�[��])��ǂݎ��B
�@(�Q)�Z���
�@�@(i) ���x�v�̃X�C�b�`�����A20�`30���҂��Ă��瑪�肷��g���̃t�B���^�[�𑪌����ɍ��킹��B
�@�@(ii)�Q�̃Z�������łQ�`�R��������A���������Z���̂Q�^�R���x�܂œ���A�Z���z���_�[�ɓ����B��O�̃Z��(�ΏƎ���)���g���āA�O�����킹�ƂP�O�O�����킹������B
�@�@(iii)�Z���z���_�[�̃n���h������O�Ɉ����A�O�����킹��������A�V���b�^�[���J���ē��ߗ�[��]��ǂݎ��B
�@(�a)Fe2+�̒�ʂ̍œK�����̌���
�@ (�P)Fe2+�W�������̒���
�p�ӂ���Ă��郂�[�������̕W�����t(1.00�~10-2[mol/L])�P�Oml���z�[���s�y�b�g�łT�O�Oml���X�t���X�R�Ɉڂ��āA���X�A�b�v����B
�@ (�Q)����g���̑I��
�@�@�@Fe2+�W�������P�Oml���z�[���s�y�b�g�łT�Oml���X�t���X�R�ɂƂ�A���_�q�h���L�V���W�A�~���n�t�Q�`�R�H�A2,2�f-dipyridyl�n�t�Qml���z�[���s�y�b�g�ŁA�Q�l�|�_�i�g���E���n�t�Qml���������ꂼ������ă��X�A�b�v����B20�����x�̈�莞�ԕ��u��A���̗n�t���Z���ɏ��ʈڂ������āA�Z���ɂQ�^�R���x�n�t������B�Z���ɕt�������H���ӂ����A���x�v�̌��H�ɒu���A�t�B���^�[�������ւ��Ă����A�e�g���̋z���x��ΏƉt�����Ƃ��đ��肷��B
�@ (�R)���g�ω��̉e��
�@�@�@��������(�a)��(�Q)�Ő|�_�i�g���E�����n�t��p�����B���̑���ɁA���L�̊e�X��̗n�t��Y�����āA���F�����n�t�̓��ߓx����т��g�𑪒肷��B
�\�P�@�g�p���鎎��
|
�L�� |
���� |
�Z�x [mol/L] |
�e�� [ml] |
|
(a) |
HCl |
6 |
1 |
|
(b) |
HCl |
0.6 |
1 |
|
(c) |
CH3COOH |
6 |
1 |
|
(d) |
�|�_�ɏn�t��1�C��2 |
6 |
2 |
|
(e) |
�|�_�ɏn�t��1�C��3 |
6 |
2 |
|
(f) |
CH3COONa |
2 |
2 |
|
(g) |
NH4OH |
1 |
1 |
|
(h) |
NH4OH |
6 |
1 |
|
(i) |
NaOH |
6 |
1 |
���j��1�G�|�_�ɏn�t�Ƃ͂U�l�|�_�n�t�ƂQ�l�|�_�n�t�������������̂ł���B
�@�@�@�@�@ ��2�G�U�l�|�_�n�t�ƂQ�l�|�_�n�t�̍�����͂P�F�P
�@�@�@�@�@ ��3�G�U�l�|�_�n�t�ƂQ�l�|�_�n�t�̍�����͂R�F�P�O
�@ (�S)��F���̂̑g���̌���
�@�@�@�@���̐����͒i�K�I�ɐi�s����̂ŁA�����œ�����S(�U)�L���[�g�z�C�I���̋z���X�y�N�g�����ǂ̂悤�ȑg���ł��邩��������K�v������B
�@�@(i)��������(�a)��(�R)�Ō��������œK������p���āA2,2�f-dipyridyl�n�t�ʂ��������Fe2+��1,2,3,4,6,8,10�{�ɂȂ�悤�ɗn�t������B
�@�@(ii) 20�����x�̈�莞�ԕ��u��A�n�t���Z���ɏ��ʈڂ������āA�Z���ɂQ�^�R���x�n�t������B�Z���ɕt�������H���ӂ����A���x�v�̌��H�ɒu���A�œK�g���̃t�B���^�[�ɂ��āA�e�n�t�̋z���x��ΏƉt�����Ƃ��đ��肷��B
�@ (�T) ���ʐ��̍쐬
�@�@(i) ��������(�a)��(�Q)�`(�S)�Ō��ʂ�p���āA���ʐ����쐬���邽�߂ɍœK����������B
�@�@(ii)�T�Oml�̃��X�t���X�R��p���āAFe2+�̕W���n�t����Z�x�O�`�Tmg/L�̑���p�n�t������B
�@�@(iii)���������n�t��p���āA���ʐ����쐬����B
�@ (�U)�z���W���̎Z�o
�@�@�@��������(�a)��(�T)�œ���ꂽ���ʂ�p���ĕ`����錟�ʐ�����A�����o�[�g�\�x�[���̖@�����烂���z���W�����Z�o����B
�@ (�V)���m��������Fe2+�̒��
�@�@�@���m�����`�C�a�C�b�C�c������B�e�������Ɋ܂܂��Fe2+�̊ܗL�ʂߗ��ׂČ��ʐ����狁�߂�B
�R�D���ʂƂ܂Ƃ�
�@(�P)�P����
�@ (i)�Z���
�Z����̌��ʂ��e�����W(�t�B���^�[)���Ƃɉ��L�̕\�Q�ɂ܂Ƃ߂��B
�\�Q�@�Z����i�P���ځj
|
�����W |
wave length |
transmittance1 |
transmittance2 |
average absorbance |
|
�P |
420 |
99.0 |
99.0 |
0.004365 |
|
�Q |
460 |
99.1 |
99.1 |
0.003926 |
|
�R |
517 |
99.2 |
99.2 |
0.003488 |
|
�S |
532 |
98.9 |
99.0 |
0.004584 |
|
�T |
562 |
98.8 |
99.1 |
0.004585 |
|
�U |
655 |
99.1 |
99.2 |
0.003707 |
�@ (ii)�œK�g���̑I��
�e�����W(�t�B���^�[)�̔g���ő��肳�ꂽ���ʂ����L�̕\�R�ɂ܂Ƃ߂��B
�\�R�@�g���Ƌz���x
|
�����W |
wave length |
transmittance1 |
transmittance2 |
average absorbance |
corrected absorbance |
|
�P |
420 |
76.2 |
76.1 |
0.11833 |
0.11397 |
|
�Q |
460 |
62.0 |
62.0 |
0.20761 |
0.20368 |
|
�R |
517 |
50.0 |
50.0 |
0.30103 |
0.29754 |
|
�S |
532 |
51.9 |
52.0 |
0.28441 |
0.27983 |
|
�T |
562 |
79.7 |
79.8 |
0.09827 |
0.09368 |
|
�U |
655 |
98.1 |
98.1 |
0.00833 |
0.00462 |
�@�܂��A��L�̕\�R�̒l��p���Đ}�P���쐬�����B
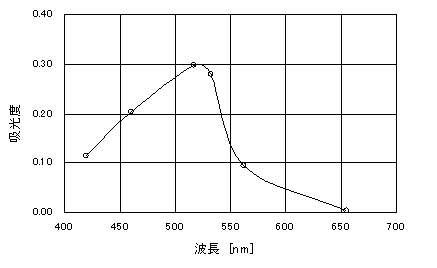
�}�P�@�z���x�Ɣg���̊W
(iii)���g�ω��ɂ��e��
(ii)�̎����̌��ʂ��A���肳�ꂽ���ߗ�����Z�o���ꂽ�z���x���ł��ǂ����x�������������W�R���œK�g���Ƃ����B�I���R�ɂ��Ă͍l�@�ɏ����B
�\�S�@���g�Ƌz���x
|
���� |
���g |
transmittance1 |
transmittance2 |
average absorbance |
corrected absorbance |
|
(a) |
1.21 |
66.0 |
65.9 |
0.1808 |
0.1773 |
|
(b) |
2.09 |
57.0 |
57.2 |
0.2434 |
0.2399 |
|
(c) |
3.00 |
49.9 |
49.6 |
0.3032 |
0.2997 |
|
(d) |
4.19 |
50.1 |
50.0 |
0.3006 |
0.2971 |
|
(e) |
4.72 |
49.8 |
49.8 |
0.3028 |
0.2993 |
|
(f) |
6.20 |
49.8 |
49.9 |
0.3023 |
0.2988 |
|
(g) |
9.80 |
60.9 |
60.7 |
0.2161 |
0.2126 |
|
(h) |
10.92 |
70.2 |
70.2 |
0.1537 |
0.1502 |
|
(i) |
12.93 |
84.9 |
84.7 |
0.0716 |
0.0681 |
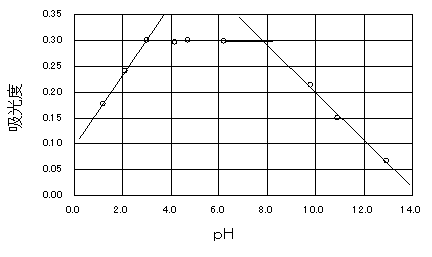
�}�Q�@�z���x�Ƃ��g�̊W
�@(�Q)�Q����
�@ (i)�Z���
�@�@�@�@�P���ڂ̌��ʂ���œK�����W�ƍl�����郌���W�R�ɂ��āA�ΏƎ����ł��鐸�����ł̑���p�Z���̓��ߗ��ׂ��B
�\�T�@�Z����i�Q���ځj
|
�@ |
transmittance1 |
transmittance2 |
average absorbance |
|
�œK�����W�R |
99.7 |
99.6 |
0.00152 |
�@ (ii)���̂̑g����̌���
�P���ڂ̎����̌��ʂ��A����̎����ł̍œK�g���ƍœK���g��������B�œK�g���̓����W�R��517nm�ŁA�œK���g�͎���(e)���������Ƃ�4.72�ł���ƍl������B���̏�����I���R�ɂ��Ă͍l�@�ɏ����B
�\�U�@���̂̑g����
|
������(Fe2+�Fdipyridyl) |
transmittance1 |
transmittance2 |
average absorbance |
corrected absorbance |
|
�P�F�P |
80.9 |
80.8 |
0.09232 |
0.09080 |
|
�P�F�Q |
64.9 |
64.9 |
0.18776 |
0.18623 |
|
�P�F�R |
53.0 |
53.0 |
0.27572 |
0.27420 |
|
�P�F�S |
50.0 |
50.0 |
0.30103 |
0.29951 |
|
�P�F�U |
50.0 |
50.0 |
0.30103 |
0.29951 |
|
�P�F�W |
51.9 |
52.0 |
0.28441 |
0.28289 |
|
�P�F�P�O |
49.9 |
50.0 |
0.30146 |
0.29994 |
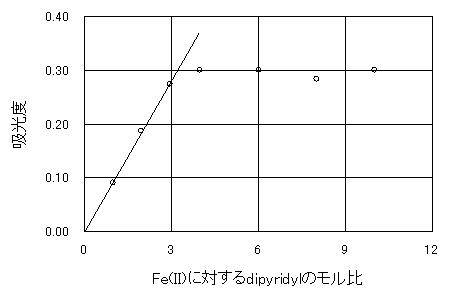
�}�R�@���̑g���̌���
2,2�f-dipyridyl���Y������Ȃ��ƁAFe2+�n�t�͍��̂��`�����邱�Ƃ��o�����A���ߗ��̓Z����̒l�Ɠ����ɂȂ�ƍl������B����āA�����䂪�O(2,2�f-dipyridyl���Y������Ă��Ȃ�)�̎��ɂ͂��ؕЂ��O(�z���x���O)�ɂȂ��ƍl������B
�܂��A2,2�f-dipyridyl�n�t��factor������ƁA��������(�a)��(�Q)�`(�R)�܂ł�Fe2+�F2,2�f-dipyridyl�̃�����͂P�F�P�O�ł���B�������ɂ��āA�\�U�͍쐬���Ă���B�������A�}�R�̃O���t��2,2�f-dipyridyl�n�t��factor���l�����Ă���B2,2�f-dipyridyl�n�t��factor��0.9863�ł���B
�ŏ����@��p���āA�ؕЂ�ʂ郂����P�F�P�`�P�F�R�܂ł̌X����0.0931�ł���B�܂��A������P�F�S�`�P�F�P�O�܂ł͂قړ������z���x�������Ă��邪�A�����䂪�P�F�W�̎��������̋z���x���傫������Ă���B�����r�����A�����䂪�P�F�S�C�P�F�U�C�P�F�P�O�̂Ƃ��̋z���x�̕��ϒl�́A
![]()
�@�@�@�ł���B���̒l��������P�F�P�`�P�F�R�܂ł̌X��0.0931�Ŋ���A���̂̑g���䂪������B
0.29965�^0.0931��3.2185
�@�@�@�����ŏo���l��3.2185�ƁA�����l�̂R�ɋ߂��B�{�����̖@������Fe2+��2,2�f-dipyridyl���̂̑g���̓������Fe2+�F2,2�f-dipyridyl���P�F�R�ł���Ɛ����ŏo����B
�@(�R)�R����
�@ (i)�Z���
�@�@�@�P���ڂ̌��ʂ���œK�����W�ƍl�����郌���W�R�ɂ��āA�ΏƎ����ł��鐸�����ł̑���p�Z���̓��ߗ��ׂ��B
�\�V�@�Z����i�R���ځj
|
�@ |
transmittance1 |
transmittance2 |
average absorbance |
|
�œK�����W�R |
99.3 |
99.2 |
0.00327 |
�@ (ii)���ʐ��̍쐬
����̎����ł̍œK�g���C�œK���g�C���̑g�����������Ă���B���̌��ʂ�p���Č��ʐ����쐬�����B�œK�g���̓����W�R��517nm�ŁA�œK���g�͎���(e)���������Ƃ��ł���B����ɁA���̂̑g���䂪�P�F�R�ł��邩��R�{�ȏ��2,2�f-dipyridyl���Y������悢�̂ŁA�Qml���������B�����ŁAFe2+�̕W���n�t�̔Z�xC [mg/L]���Z�o����B
![]()
Fe2+�̕W���n�t�P�Oml���T�Oml�Ɋ�߂��āA���ʐ��𑪒肷�鎖����Ƃ����B����āAFe2+�̕W���n�t���P�C�Q�C�R�C�S�C�Tml�̎悵�āA�������߂��Ċe�̔Z�x�̌��ʐ����쐬�����BFe2+�̊e�Z�xCi[mg/L]���Z�o���鎮�͈ȉ��̎��ł���B�������A�̎悵��Fe2+�̕W���n�t�̗e�ʂ�Vi[ml]�Ƃ���B
![]()
�\�W�@���ʐ�
|
�Z�xCi [mg/L] |
transmittance1 |
transmittance2 |
average absorbance |
corrected absorbance |
|
1.117 |
92.8 |
92.8 |
0.03245 |
0.02918 |
|
2.234 |
86.6 |
86.9 |
0.06173 |
0.05846 |
|
3.351 |
80.6 |
80.8 |
0.09313 |
0.08986 |
|
4.468 |
75.1 |
75.1 |
0.12436 |
0.12109 |
|
5.585 |
70.0 |
70.0 |
0.15490 |
0.15163 |
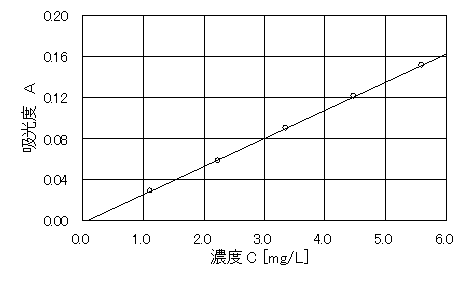
�}�S�@���ʐ�
�@�@�@�@�}�S�̃O���t�̎��́A�`��0.0275C�|0.0022�ł���B�܂��A���ϓ��덷��0.9999�ł������B�}�S�͗L�����������āA�o���邾�������̌����𗘗p�����B�L���������R���ł̎��́A�`��0.0276C�|0.0023�ł���A���ϓ��덷��0.9999�ł������B
�@ (iii)�����z���W���̎Z�o
�@�@�@�@(�R)��(ii)�Ō��ʐ��̃O���t�̎�����A�����z���W�����Z�o����B
�@�@�@�@Fe2+�Pmg����̕����ʂ�Fe�̌��q��55.85�Ƃ���ƁA1.00�~10-3�^55.83 [mol/mg(Fe)]�ł���B�܂������o�[�g�E�x�[���̎����Á��` �^cL�ƕϊ��ł���B�L�����������ē��������`��0.0275C�|0.0022�ł���̂ŁA�Z�xC [mg/L]�������Z�xc �ɕϊ�����ƁA�X���������Z�x�ɔ�Ⴗ��`�ɕϊ����Ȃ��Ă͂Ȃ�Ȃ��B����ɁA�e�Z�x���P�Oml�̎悵�ĂT�Oml�Ɋ�߂����ƍl���Ȃ��Ă͂Ȃ�Ȃ��B�Z���̕�L[cm]���Pcm�Ɖ��肵�āA�ؕЕ������ƁA�����z���W����[L/ mol cm]�́A
�@�@�@�@�@�Á�0.0275�~{ 55.83�^(1.00�~10-3)}�~�T�^�P�|0.0022��7679.37
�@�@�@�ƂȂ�B
�@�@�@�@���l�ɁA�{�����ł̑���l�͗L�������R���Ȃ̂ŁA�L�������R���ŊW����p���Ẵ����z���W����[L/ mol cm]�́A
�@�@�@�@�@�Á�0.0276�~{ 55.83�^(1.00�~10-3)}�~�T�^�P�|0.0023��7707.30
�@�@�@�ł���B
�@ (iv)���m�����̒��
�@�@�@�@���m�����S��̒�����`�Ƃa��I��Œ�ʂ��s�����B�e���m������(ii)�̌��ʐ��쐬�̏����Ɠ��������ő��肵�����ߗ���\�Ɏ����B
�\�X�@���m����
|
���m���� |
transmittance1 |
transmittance2 |
average absorbance |
corrected absorbance |
|
�` |
89.1 |
89.0 |
0.05037 |
0.04710 |
|
�a |
82.7 |
82.8 |
0.08223 |
0.07896 |
�@�@�@�@�����ŁA�L�������̌����ɂ�郂���z���W���Ɩ��m�����̔Z�x�̈Ⴂ�������B���m�����̔Z�x���Z�o���@�́A(�R)��(ii)�œ���ꂽ�Z�x�Ƌz���x�̊W�̎��ɁA������z���x�������ċ��߂��B
�\�P�O�@�L�������̌������Ⴂ
|
|
�L������ �� |
�L������ �R�� |
�� �b���|�R���b |
|
�����z���W���@[L/mol cm] |
7679.37 |
7707.30 |
27.9249 |
|
���m�����`�̔Z�x�@[mg/L] |
1.79260 |
1.62319 |
0.16942 |
|
���m�����a�̔Z�x�@[mg/L] |
2.95136 |
2.77899 |
0.17238 |
�S�D�l�@
�@(�P)�z���x�̕
�@�@�@�@�Z����ŋ��߂����ߗ���p���āA�z���x������B
�Z����ŋ��߂����ߗ��͑ΏƃZ���ɔ�ׂāA�����Z���œ��ˌ������炩�̗��R�ɂ�茸�����ē��ߗ����P(100��)�������Ȃ��̂ł���B����āA�����Z���Ɏ�������ꂽ�Ƃ��A�����Z�x�ƍ��̐����ܔZ�x���n�}�ʂɔ�ׂċɒ[�ɏ��Ȃ����̊e���ߗ��͂P�ɋߎ��ł���B���o�����̓��ˌ��̋��x�C���ߌ��̋��x�C���ߗ��C�z���x�����ꂼ��I0 �Clt �C�s�C�`�Ƃ��āA�Z����ł��ˌ��̋��x�C���ߌ��̋��x�C���ߗ��C�z���x��I0�f �Clt�f �C�s�f�C�`�f�Ƃ���B��������ƁA�f�ΏƃZ���ł̓��ˌ���I0 �~�s�Ȃ�̂ŁA
log (I0 �~�s�f�^lt) ��log {(I0
�^lt )�~(lt�f �^I0�f)}
��log (I0 �^lt ) �|log (I0�f
�^lt�f )
��log (�P�^�s) �[log (�P�^�s�f)
���`�|�`�f
�@�@�@�ƁA������^�̋z���x���Z�o�ł���B�������A�������ł�I0 ��I0�f�ł���B
(�Q)�œK�g��517nm(�����W�R)��I���������R
�@�@�@�@�ړI�����ł���Fe2+���܂ލ��̂̋z���Ȑ�(�}�P)�ŋɑ�z���g���ł��߂ł���B�ɑ�z���g�����ǂ����R�́A���x�������A�g���̐ݒ�ɑ����̌덷�������Ă��z���x�ւ̉e�������Ȃ����߂ł���B
�@(�R) ����(e)��Y�����������œK���g�ł���ƍl�������R
�@�@�@�@�}�Q�����Ă�������悤�ɁA�����œ����O���t�̌`�͑�`�ł���B���̐�����(Lewis����)���u�����X�b�e�h�̉���Ƃ��Ă��������߂ɂ��g�̕ω������ʂł���B�������A���̐�����W���ɂȂ�قǂ̑�ʂ̎_�≖��Ȃ�����A���̐����܂̔Z�x�͂��g�ɂ���ĕω����Ȃ��B����͍��́[�z�ʎq���̂��z�ʎq�ɏՍ܂Ƃ��ē����Ă��邽�߂ł���B
���̂��ߔz�ʎq�ɏՍ܂Ƃ��ē����Ă���̈悪�œK���g�̗̈悾�ƍl�������B���̗̈�̒��ŁA���ɒ��������͂��g�������ω����Ă��傫�ȉe�����ɂ����̂ŁA��`�̏�������̒����ɋ߂����g�ɂȂ����Ƃ��ɉ���������(e)�����g�����܂Ƃ��đI�������B
(�S)���ʐ��̍쐬
�@�@�@���ʐ��̍쐬�̃O���t(�}�S)�́A�L���������o������葽���g���č쐬�����B���̎��́A�`��0.0308C�|0.0022�ł���B�`�͋z���x�ŁA�b��Fe2+�̔Z�x[mg/L]�ł���B���ϓ��덷��0.9999�Ƌɂ߂�1.000�ɋ߂�������A���Ȃ萸�x�����������ł������̂łȂ����Ǝv���B�������Ȃ���A�{�����ł͑���l�̗L�������͂R���ł���B�L�������R���ŋ��߂��W�����܂��A���ϓ��덷��0.9999�ł������B���̎���
�`��0.0276C�|0.0023�ł���B�L�������̌����ɂ�鎮�̌W���Ȃǂ̉e���͏������B�܂��A�L���������R���ł����ϓ��덷��0.9999��1.000�ɋ߂�������������̑���덷�͉e�����ɂ����Ƃ̌�����Ǝv���B
�@(�T)�����z���W���Ɩ��m�����̔Z�x����
�@�@�@�@�����z���W���͗L�������ɊW�Ȃ��A���_�l�Ƃ͑傫���O�ꂽ�B����͎g�p�����Z���̗n�t�����镝���Pcm�����ł��������߂ł��낤�B���ɂ́AFe2+�̌��t�܂��͕W���n�t�̔Z�x���Z�������Ƃ�����������B����Ɋ֘A���āA���m�����̔Z�x�Z�o�ŗ��_�l���������l���o�Ă��܂����̂����\������B
�@�@�@�@�܂����_�l����̌덷���߂��L�������R���̕����A�����҂̓��v�덷���o���ƍl���₷���A���ۂɂ͂�����̕������ۂ̒l�ɋ߂��̂łȂ����낤���B
�\�P�P�@���_�l�Ƃ̔�r
|
�@ |
�L������
�� |
�L������
�R�� |
���_�l�Ƃ̍�(��) |
���_�l�Ƃ̍�(3��) |
|
�����z���W��[L/mol cm] |
7679.37 |
7707.30 |
970.63 |
942.7023 |
|
���m�����`�̔Z�x[mg/L] |
1.79260 |
1.62319 |
0.20740 |
0.37681 |
|
���m�����a�̔Z�x[mg/L] |
2.95136 |
2.77899 |
0.04864 |
0.22101 |
�@�@�@���j�����z���W���̗��_�l�̓Á�8650�ŁA�g���Ɂ�522nm�ő��肵�����̂ł���B
(�U)�œK�����̌��ʂ���A������Fe(�U)�̒�ʕW������
�@�@���x�v�̃X�C�b�`�����A20�`30���҂B
�@�A�g����517nm(�t�B���^�[�R)�ɍ��킹�āA�������ŃZ���������B����͂Q��s���B
�@�B���肵�����n�t���z�[���s�y�b�g��10ml�C10�����_�q�h���L�V���A�~���n�t���Q�`�R�H�C�z�[���s�y�b�g��2,2�f-dipyridyl�n�t�Qml�C���g������(����(e) pH=4.72) 2ml���L�ڂ̏��Ԃ�50ml���X�t���X�R�ɓ���A�������Ń��X�A�b�v����B
�@�C�悭���a���āA20�`30���̈�莞�Ԃ������B
�@�D���������n�t�ŃZ���������āA�Z����2/3���x�܂ŗn�t�����A�Z���̎���̐������e�B�b�V���ł��ꂢ�ɂӂ����B
�@�E��O�̃Z��(�ΏƎ�����������)���g���āA�O�����킹�ƂP�O�O�����킹������B
�@�F���ߗ��𑪒肷��B����͂Q��s���B
�T�D�ۑ�
�@(�P)�L�ڂ���Ă���\�����A�f�[�^���番����V���Ȑ��l���g�������B
�\�P�Q�@�S�T���v�����̃}���K��
|
Sample Number |
�P |
�Q |
�R |
�S |
�U |
Unknown |
|
Mn [%] |
0.160 |
0.256 |
0.360 |
0.480 |
0.600 |
a |
|
Weight of sample [g] |
0.4400 |
0.4096 |
0.3896 |
0.4160 |
0.4016 |
0.3928 |
|
Weight of Mn
[mg] |
0.704 |
1.049 |
1.403 |
1.997 |
2.410 |
b |
|
Transmittance [%] |
64.86 |
52.12 |
41.98 |
28.91 |
22.39 |
34.83 |
|
Absorbance |
0.1880 |
0.2830 |
0.3770 |
0.5390 |
0.6499 |
0.4580 |
�@�@
�@�@�@�}���K���̏d��[mg]�́A�T���v���̏d��[g]�ƃ}���K���̊ܗL��[%]���������l�ł���B���Ȃ킿�A
![]() �@�E�E�E�E�@�i���j
�@�E�E�E�E�@�i���j
�ł���B�}���K���̏d��[mg]�Ƌz���x�̊W��\�����O���t�Ɖ��L�Ɏ����B
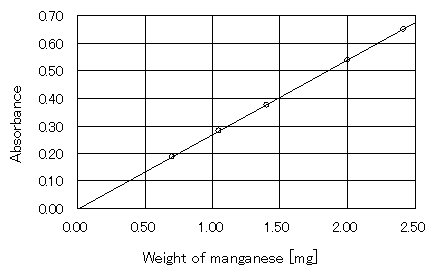
�}�T�@�S�T���v�����̃}���K��
�@�@�@�@�@�}�T�̒����̎��́A����0.2706���|0.0019�ł���B���ϓ��덷��1.000�ł���B���ߗ����������Ă��邽�ߋz���x��������̂ŁA�}���K���̏d����[mg]���킩��B
�@�@�@�@�@�@�@![]()
�@�@�@�@�ł��邩��A���m�������̃}���K���̏d����[g]��1.700[mg]�ł���B(��)������A���m�����S�T���v�����̃}���K���̊ܗL��[%]�́A
�@�@�@�@�@�@�@![]()
�@�@�@�@�ł���B����āA���m�������̃}���K���̊ܗL������0.4328[%]�ł���B
�@(�Q)�A���ω��@
�@�@�@�@�����C�I���l�Ɣz�ʎq�k�̍��̂l���k���������̂Ƃ���A���C�������ꂼ��l�Ƃk�̏��Z�x�A�������̐����Z�x�Ƃ���ƁA���t��Ԃł́A
![]()
![]() �@�@�@�ł���B���̕��@�ł͂l�Ƃk�̃����Z�x�̘a(a+b)�����lc�Ǝ��悤��a��b�����悤�ɁAa��b�̒l��ς��č��̐����̗̂ʂׂ�ł���̂ŁA���̂悤�ɕϊ�����B
�@�@�@�ł���B���̕��@�ł͂l�Ƃk�̃����Z�x�̘a(a+b)�����lc�Ǝ��悤��a��b�����悤�ɁAa��b�̒l��ς��č��̐����̗̂ʂׂ�ł���̂ŁA���̂悤�ɕϊ�����B
![]()
�@�@�@�@�@�����C�I���Z�xa���O����c�܂ŕω��������Ƃ��A���̔Z�xc���ɑ�ƂȂ�����́Adx�^da=0�ł���Bmb=na�ƂȂ�悢�Bm/(n+m)=a/c��U���ł���B
�@�@�@�@���������āA�����C�I���Z�xa�Ǝ���Z�xb�̘ac=a+b�����ɕۂ��Aa�Cb�̊�����ς��č��̔Z�x(�z���x)�𑪒肷��Ƃ��A�c����x(�z���x)�A������a/c���v���b�g���āAx�̋ɑ�ɑΉ�����a/c�����߂āA���̑g�������肷�鎖���o����B
�@�@�@�@��������ł́A�����C�I���܂��͔z�ʎq�̋z�����Ȃ��A���݂̂̂��z�������������]�܂����B�~�ޓ��Ȃ��ꍇ�́A�����̋z������}��ŕ���āA�g�������߂鎖���o����B���ۂɑg�������肷��ꍇ�ɂ́A������@�ƕK�����s���čs�����_���o���悤�ɂ���B
�U�D�Q�l����
����P�Y�C���J��v�����F�@�핪�͉��w�̊�b�C�ۑP������ЁC1985
H.FREISER���F���͉��w�@�|���_�ƌv�Z�|�C�������w���l�C1994
�������Y�Ғ��F��b���w�I��20�@���͉��w�����C�։ؖ[�C1986
�]�����`�Ғ��F�@�핪�͂̊�b�C�։ؖ[�C1998
�ʒ������ҏW�F�����w���T�@��R�ő���ŁC��g���X�C1986