1.目的
酢酸エチルの加水分解反応を水が過剰に存在する条件、すなわち水溶液中で行う場合、水の減少量を無視できるので水の濃度を定数と考えることができる。酢酸エチルの加水分解反応の分解速度は、近似的に酢酸エチルの濃度に1次として取り扱える。この事を実験により確認する。
反応速度の解析法には、積分法と微分法がある。各方法を用いて反応次数の決定を行うと供に、各方法の特色を学ぶ。これらの事を通して、反応速度論へ理解を深める」。
2.実験原理
今回の実験の軸となる積分法と微分法について説明する。
化学反応が次式で表されるような反応を考える。
A + B → 生成物 (1)
この反応が単にAとBの衝突により進行する反応であるならば、反応速度はAとBの単位時間当たりの衝突回数に比例する。衝突回数はAとBの濃度(CA,CB,正確に活量)に比例する。反応速度rは次式で表される。
r=kCACB (2)
一般に化学反応の速度は、温度が一定の場合、反応物の濃度だけの関数として表せる。その反応速度式が、
r=kCAaCBb・・・CNn (3)
と表されるとする、この反応次数はAに関してa次、Bに関してb次、・・・という。
いまa=1、bからnまで=0のとき(3)式は単に、
r=kCA (4)
となる。この場合の反応を1次反応という。たま、反応速度はCAの時間変化で表されるから、
![]() (5)
(5)
となる。(4)式と(5)式より、1次反応の速度式は、
![]() (6)
(6)
という微分方程式が記述される。これが微分法である。
また、(5)式の対数をとると、
ln r = ln
CA + ln k (7)
である。ここで、この反応がCAにn次であるとると、
ln r =n ln
CA + ln k
(8)
でる。実験により初濃度を変えることにより、nを算出できる。
ここでt=0のとき、でCA=CA0(初濃度)として(6)式を積分すると
![]()
![]()
ln (CA / CA0) =-kt (9)
である。これがCAに反応速度が1次であるときの積分形速度式である。
ここで、今回実験で行う反応を考える。酢酸エチルの加水分解反応は以下の式のように書ける。
![]()
酢酸エチルが過剰の水で加水分解反応を起こすとする。実際の実験では酢酸エチルの量が水の量を大過剰にするので、水の濃度は実験中変化しないとみなせる。
よって、上記で求めたような1次反応の速度式を適用して、酢酸エチルの反応速度を算出できる。
3.実験方法
[1週目]
[A]
(i)約10M NaOHaqを10ml量りとり、1Lのポリビンに移してイオン交換水で約0.1Mに希釈する。
(ii)既知のファクター(f=1.080)の0.1M フタル酸水素カリウム(KHP)溶液で約0.1Mに調製したNaOHaqの濃度を標定する。被滴下のフタル酸水素カリウム溶液はホールピペットを用い、20mlをコニカルビーカーに入れ滴定する。
(iii) 滴定誤差が0.05ml以内に入るものが3回あれば滴定は終了である。
(iv)滴定誤差0.05ml以下の3回の値から平均値を算出し、NaOHaq濃度を決定する。
[B]
(i)200ml三角フラスコに精製水80ml,2M HClaq 20mlをそれぞれ40,20mlホールピペットを用いて量り取る。
(ii)三角フラスコは約25℃(2日目は35℃)の恒温槽に入れ、クランプで固定する。
(iii)別の三角フラスコ5個に精製水を約50ml入れ、ゴム栓をしてから氷浴で冷却する。
(iv) (ii)で調整したHClaqが一定温度になるまで15分間放置する。
(v)氷冷した精製水をコニカルビーカーに移し、フェノールフタレインを加える。
(vi) 所定の温度の酢酸エチル5mlホールピペットで分取し、(iv)で用意した三角フラスコに入れよく撹拌する。よく撹拌した三角フラスコからホールピペットで5ml分取し、(v)で用意したコニカルビーカーに入れる。
(vii)三角フラスコを素早く恒温槽に入れる。このときの時間をt=0とする。
抜き取ったサンプルを素早く滴定する。以後10,20,30,50,70,90分後にも同様の操作を行う。経過した時間をtとする。
[2週目]
[A]
(i)約2.5M NaOHaqを10ml量りとり、1Lのポリビンに移してイオン交換水で約0.025Mに希釈する。そして、よく撹拌する。
(ii)既知のファクター(f=1.043)の0.025M フタル酸水素カリウム(KHP)溶液で約0.025Mに調製したNaOHaqの濃度を標定する。被滴下のフタル酸水素カリウム溶液はホールピペットを用い、20mlをコニカルビーカーに入れ滴定する。
(iii) 滴定誤差が0.05ml以内に入るものが3回あれば滴定は終了である。
(iv)滴定誤差0.05ml以下の3回の値から平均値を算出し、NaOHaqを決定する。
[B]
(i)200ml三角フラスコ4つに精製水50mlを採取し、ゴム栓をしてから氷浴で冷却する。
(ii)100mlメスフラスコに酢酸エチル5mlを入れ、精製水でメスアップする。
(iii)乾燥済みの三角フラスコを用意し、(ii)で調整した酢酸エチル水溶液を全量移す。ゴム栓をしてから約25℃の恒温槽に入れ、20分間放置して温度が一定になるのを待つ。
(iv)待ち時間の間に、反応と滴定の準備をする。具体的には、塩酸採取用の5mlホールピペットとサンプル採取用の5mlホールピペット、サンプルを分取する200mlコニカルビーカーである。5mlの混在に注意するため、赤のテープが付いているものを塩酸用とし、青のテープが付いているものをサンプリング用とする。
(v)氷冷した精製水をコニカルビーカーに移し、フェノールフタレインを加える。
(vi)ホールピペットを用いてHClaq 5mlを採取し、(iii)で用意した三角フラスコに入れよく撹拌する。その後、その三角フラスコからホールピペットで5ml分取し、(v)で用意したコニカルビーカーに入れる。
(vii)三角フラスコを素早く恒温槽に入れる。このときの時間をt=0とする。
抜き取ったサンプルを素早く滴定する。以後10,20,30分後にも同様の操作を行う。経過した時間をtとする。
4.結果とまとめ
[1週目]
(i)0.1[mol/L] NaOHaqの標定
0.1[mol/L] KHPaqのfactor f=1.080
|
回数 |
1 |
2 |
3 |
4 |
5 |
|
ビュレットの値 前 |
0.00 |
0.00 |
0.00 |
0.00 |
0.00 |
|
後 |
22.01 |
21.89 |
21.90 |
21.97 |
21.96 |
|
滴定量[ml] |
22.01 |
21.89 |
21.90 |
21.97 |
21.96 |
滴定量の平均値を算出する用いるデータは、1,4,5回目の値である。
0.1[mol/L] NaOHaqの濃度をCとすると
0.1 ×1.080 ×(22.01+21.97+21.96) /3 =C ×20
∴ C =0.0982712
=0.09827
=9.827×10-2 [mol/L]
0.1[mol/L] NaOHaqのfactor
f=0.09827 /0.1000 =0.9827
(ii)25℃での時間ごとの酢酸エチルの反応量
t分後の滴定量Vt,t=0での滴定量V0をする。
時間ごとのNaOHaqの滴定量を示す値を示す。
表1 25℃での滴定量
|
時間 t [min] |
0 |
10 |
20 |
30 |
50 |
70 |
90 |
|
ビュレットの値 前 |
0.00 |
0.00 |
0.00 |
0.00 |
0.00 |
0.00 |
0.00 |
|
後 |
24.18 |
25.19 |
26.04 |
26.82 |
28.23 |
29.60 |
31.12 |
|
滴下量 Vt [min] |
24.18 |
25.19 |
26.04 |
26.82 |
28.23 |
29.60 |
31.12 |
|
Vt-V0 [min] |
0.00 |
1.01 |
1.86 |
2.64 |
4.05 |
5.42 |
6.94 |
これらの値から、サンプル5ml中に含まれる酢酸エチルの反応量を[mol]算出する。Vt-V0が酢酸エチルの加水分解で生成した酢酸と反応するのに要したNaOHaqの量とすると、酢酸エチルの反応量=酢酸の生成量である。よって、サンプル5ml中に含まれる酢酸エチルの反応量を求める一般式は、
CNaOH×(Vt-V0)×10-3 =0.09827×(Vt-V0)×10-3
である。
t=0 ; 0.09827×(0.00)×10-3
=0.00 [mol]
t=10 ; 0.09827×(1.01)×10-3 =9.92537×10-5
=9.925×10-5 [mol]
t=20 ; 0.09827×(1.86)×10-3 =1.82784×10-4
=1.828×10-4 [mol]
t=30 ; 0.09827×(2.64)×10-3 =2.59435×10-4
=2.594×10-4 [mol]
t=50 ; 0.09827×(4.05)×10-3 =3.97998×10-4
=3.980×10-4 [mol]
t=70 ; 0.09827×(5.42)×10-3 =5.326929×10-4
=5.327×10-4 [mol]
t=90 ; 0.09827×(6.94)×10-3 =6.82001×10-4
=6.820×10-4 [mol]
有効数字が1桁多いように思えるが、Vt-V0の有効数字は実際、4桁引く4桁なので有効桁数は変化せず4桁のままである。わかりやすいように、上記の計算では直接Vt-V0の値を代入している。
また、反応した酢酸エチルの反応量の濃度C’t[mol/L]は、上記の計算で出した酢酸エチルの反応量[mol]が5ml中のものなので、1000/5=200をかければよい。計算結果は簡単に算出できるので、表2にまとめた。
表2 25℃での酢酸エチルの反応量
|
時間 t [min] |
0 |
10 |
20 |
30 |
50 |
70 |
90 |
|
酢酸エチル反応量 [mol/5ml] |
0.000 |
9.925 ×10-5 |
18.28 ×10-5 |
25.94 ×10-5 |
39.80 ×10-5 |
53.26 ×10-5 |
68.20 ×10-5 |
|
酢酸エチル反応量 C’t [mol/L] |
0.000 |
1.985 ×10-2 |
3.656 ×10-2 |
5.189 ×10-2 |
7.960 ×10-2 |
10.65 ×10-2 |
13.64 ×10-2 |
反応した酢酸エチルの量がわかったので、反応せずに残っている酢酸エチルの量を算出できる。すなわち、残っている酢酸エチル濃度Ctを算出できる。Ctを算出できるので、ln (Ct/ C0)を算出できることになる。C0は酢酸エチルの初濃度である。
20℃での酢酸エチルの密度をd20=0.901とし、酢酸エチルの分子量を88.11とする。
C0 =5×0.901/88.11×1000/(80+20+5)=0.486945
=0.4869 [mol/L] (=48.69×10-2)
Ct =C0 -C’t = 0.4869 -C’t [mol/L]である。
t=0 ; C0=48.69×10-2 -0.00=0.4869 [mol/L]
t=10 ; C10=48.69×10-2 -1.985×10-2=0.46705
=0.4671 [mol/L]
t=20 ; C20=48.69×10-2 -3.656×10-2=0.45034
=0.4503 [mol/L]
t=30 ; C30=48.69×10-2 -5.189×10-2=0.43501
=0.4350 [mol/L]
t=50 ; C50=48.69×10-2 -7.960×10-2=0.40730
=0.4073 [mol/L]
t=70 ; C70=48.69×10-2 -10.65×10-2=0.3804 [mol/L]
t=90 ; C90=48.69×10-2 -13.64×10-2=0.3505 [mol/L]
よって、C0と共にCtも求まったので、ln (Ct/ C0)を算出できる。
t=0 ; ln (C0/
C0)=ln(0.4869/0.4869)=定義外
t=10 ; ln (C10/
C0)=ln(0.4671/0.4869)=-0.041620068
=-0.04162
t=20 ; ln (C20/ C0)=ln(0.4503/0.4869)=-0.078041258
=-0.07804
t=30 ; ln (C30/
C0)=ln(0.4351/0.4869)=-0.112671922
=-0.1127
t=50 ; ln (C50/
C0)=ln(0.4073/0.4869)=-0.178489312
=-0.1785
t=70 ; ln (C70/
C0)=ln(0.3804/0.4869)=-0.246877035
=-0.2469
t=90 ; ln (C90/
C0)=ln(0.3505/0.4869)=-0.328662172
=-0.3287
表3 25度での酢酸エチルの反応量濃度と残量濃度
|
時間 t [min] |
0 |
10 |
20 |
30 |
50 |
70 |
90 |
|
C't [mol/L] |
0.0000 |
0.01985 |
0.03656 |
0.05189 |
0.07960 |
0.1065 |
0.1364 |
|
Ct [mol/L] |
0.4869 |
0.4671 |
0.4504 |
0.4351 |
0.4073 |
0.3804 |
0.3505 |
|
Ln Ct/C0 |
ー |
-0.04162 |
-0.07804 |
-0.1127 |
-0.1785 |
-0.2469 |
-0.3287 |
(iii)35℃での時間ごとの酢酸エチルの反応量
t分後の滴定量Vt,t=0での滴定量V0をする。
時間ごとのNaOHaqの滴定量を示す値を示す。
表4 35℃での滴定量
|
時間 t [min] |
0 |
10 |
20 |
30 |
50 |
70 |
90 |
|
ビュレットの値 前 |
0.00 |
0.00 |
0.00 |
0.00 |
0.00 |
0.00 |
0.00 |
|
後 |
24.09 |
26.40 |
28.01 |
29.57 |
32.39 |
34.76 |
36.70 |
|
滴下量 Vt [min] |
24.09 |
26.40 |
28.01 |
29.57 |
32.39 |
34.76 |
36.70 |
|
Vt-V0 [min] |
0.00 |
2.31 |
3.92 |
5.48 |
8.30 |
10.67 |
12.61 |
これらの値から、サンプル5ml中に含まれる酢酸エチルの反応量[mol]を算出する。
計算法は3-(ii)と同様の方法である。
t=0 ; 0.09827×(0.00)×10-3
=0.00 [mol]
t=10 ; 0.09827×(2.31)×10-3 =2.22700×10-4
=2.227×10-4 [mol]
t=20 ; 0.09827×(3.92)×10-3 =3.85218×10-4
=3.852×10-4 [mol]
t=30 ; 0.09827×(5.48)×10-3 =5.38519×10-4
=5.385×10-4 [mol]
t=50 ; 0.09827×(8.30)×10-3 =8.15641×10-4
=8.156×10-4 [mol]
t=70 ; 0.09827×(10.67)×10-3 =1.04854×10-3
=1.049×10-3 [mol]
t=90 ; 0.09827×(12.61)×10-3 =1.23918×10-3
=1.239×10-3 [mol]
こちらも有効数字が1桁多いように思えるかもしれないが、25℃の時と同じ理由で有効数字が4桁なのである。
また、反応した酢酸エチルの反応量の濃度C’t[mol/L]は、上記の計算で出した酢酸エチルの反応量[mol]が5ml中のものなので、1000/5=200をかければよい。計算結果は簡単に算出できるので、表にまとめた。
表5 25℃での酢酸エチルの反応量
|
時間 t [min] |
0 |
10 |
20 |
30 |
50 |
70 |
90 |
|
酢酸エチル反応量 [mol/5ml] |
0.00 |
2.270 ×10-4 |
3.852 ×10-4 |
5.385 ×10-4 |
8.156 ×10-4 |
10.49 ×10-3 |
12.39 ×10-3 |
|
酢酸エチル反応量 C’t [mol/L] |
0.00 |
4.504 ×10-2 |
7.704 ×10-2 |
10.77 ×10-2 |
16.31 ×10-2 |
20.98 ×10-2 |
24.78 ×10-2 |
反応した酢酸エチルの量がわかったので、反応せずに残っている酢酸エチルの量を算出できる。すなわち、残っている酢酸エチル濃度Ctを算出できる。Ctを算出できるので、ln (Ct/ C0)を算出できることになる。C0は酢酸エチルの初濃度である。
2-(ii)より、C0 =0.4869 [mol/L] (=48.69×10-2)
算出方法を2-(ii)を同様である。
t=0 ; C0=48.69×10-2 -0.00=48.69×10-2
[mol/L]
t=10 ; C10=48.69×10-2 -4.504×10-2=0.44186
=0.4419 [mol/L]
t=20 ; C20=48.69×10-2 -7.704×10-2=0.40986
=0.4099 [mol/L]
t=30 ; C30=48.69×10-2 -10.77×10-2=0.3792 [mol/L]
t=50 ; C50=48.69×10-2 -16.31×10-2=0.3238 [mol/L]
t=70 ; C70=48.69×10-2 -20.98×10-2=0.2771 [mol/L]
t=90 ; C90=48.69×10-2 -24.78×10-2=0.23.91 [mol/L]
よって、C0と共にCtも求まったので、ln (Ct/ C0)を算出できる。
t=0 ; ln (C0/
C0)=ln(0.4869/0.4869)=定義外
t=10 ; ln (C10/
C0)=ln(0.4419/0.4869)=-0.097873872
=-0.09787
t=20 ; ln (C20/ C0)=ln(0.4099/0.4869)=-0.172236479
=-0.1722
t=30 ; ln (C30/
C0)=ln(0.3792/0.4869)=-0.249981721
=-0.2500
t=50 ; ln (C50/
C0)=ln(0.3238/0.4869)=-0.407977937
=-0.4080
t=70 ; ln (C70/
C0)=ln(0.2771/0.4869)=-0.5632861221
=-0.5633
t=90 ; ln (C90/
C0)=ln(0.23.91/0.4869)=-0.7112452271
=-0.7112
表6 35度での酢酸エチルの反応量濃度と残量濃度
時間 t [min] |
0 |
10 |
20 |
30 |
50 |
70 |
90 |
|
C't [mol/L] |
0.0000 |
0.04540 |
0.07704 |
0.1077 |
0.1631 |
0.2097 |
0.2478 |
|
Ct [mol/L] |
0.4869 |
0.4415 |
0.4099 |
0.3792 |
0.3238 |
0.2772 |
0.2391 |
|
Ln Ct/C0 |
- |
-0.09787 |
-0.1722 |
-0.2500 |
-0.4080 |
-0.5633 |
-0.7112 |
(iv)ここまで求めてきたものをまとめる。
表1と表4より、図1を作成した。
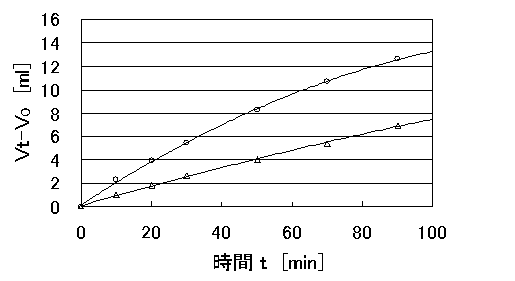
図1 時間tとVt-V0の関係
表3と表6より、図2を作成した。
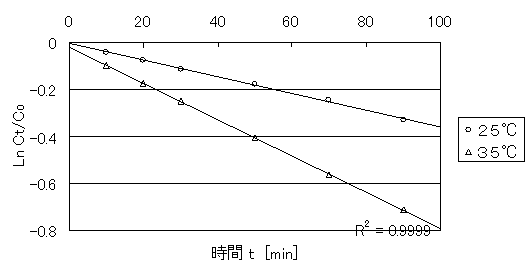
図2 時間tとLn (Ct/C0) の関係
図2より傾きを求めることが出来る。この傾きは反応速度定数kである。しかし、ここで求められるkは、1次反応に近似したときの反応速度定数である。
25℃ ; Ln (Ct/C0) =-0.00353t-0.0056
∴k25=0.00353
35℃ ; Ln (Ct/C0) =-0.00772t-0.0199
∴k25=0.00772
また、同一の反応で異なる温度の反応速度定数がわかれば、Arrheniusの式で近似的に活性化エネルギーを算出できる。反応速度定数kは反応温度(T)の関数で事にも注しなくてはならない。アレニウスの式は以下の式で表される。
k=A exp(-Ea/RT) A:頻度因子 (10)
2つの実験結果がArrheniusの式の適用できる温度範囲内と仮定すると、2点の温度間で求まったk25とk35を上記(10)式に適用すると、
k25=A exp(-Ea/RT25) k35=A exp(-Ea/RT35)
の2つの式のから次の関係式を導ける。
![]() (11)
(11)
よって、今回の行った塩酸触媒下での酢酸エチルの加水分解反応の活性化エネルギーEaは、
Ea =8.3145×(273.14+25.0)(273.14+35.1)/(35.07-25.04)
=59199
=5.91×104 [J]
=59.1 [kJ]
ただし、T25=273.14+θ25,T35=273.14+θ35である。θ25とθ35は恒温槽の平均温度である。恒温槽の各時間内の温度を以下の表5に示す。
注)恒温槽のデジタル温度計の値を記録していた。実際の温度計を約1度の誤差があることに気付いたので、測定データより-1の値を記してある。
表7 恒温槽の温度変化
|
時間 t[min] |
0 |
10 |
20 |
30 |
50 |
70 |
90 |
|
θ25 [℃] |
24.9 |
25.4 |
24.9 |
25.0 |
25.0 |
25.0 |
25.1 |
|
θ35 [℃] |
33.1 |
34.6 |
36.0 |
35.6 |
35.6 |
35.3 |
35.3 |
θ25=(24.9+25.4+24.9+25.0+25.0+25.0+25.1)/7=25.042
=25.0
θ35=(33.1+34.6+36.0+35.6+35.6+35.3+35.3)/7=35.071
=35.1
[2週目]
(i)0.025[mol/L] NaOHaqの標定
0.025[mol/L] KHPaqのfactor f=1.043
|
回数 |
1 |
2 |
3 |
|
ビュレットの値 前 |
0.00 |
0.00 |
0.00 |
|
後 |
21.11 |
21.07 |
21.10 |
|
滴定量[ml] |
21.11 |
21.07 |
21.10 |
0.025[mol/L] NaOHaqの濃度をCとすると
0.025 ×1.043×(21.11+21.07+21.10) /3 =C ×20
∴ C =0.0247235
=0.02472
=2.472×10-2 [mol/L]
0.1[mol/L] NaOHaqのfactor
f=0.02472 /0.02500 =0.9888
(ii)5ml酢酸エチルでの時間ごとの酢酸エチルの反応量
t分後の滴定量Vt,t=0での滴定量V0をする。
時間ごとのNaOHaqの滴定量を示す値を示す。
表8 滴定量(5ml)
|
時間 t [min] |
0 |
10 |
20 |
30 |
|
ビュレットの値 前 |
0.00 |
0.00 |
0.00 |
0.00 |
|
後 |
22.82 |
23.60 |
24.21 |
25.03 |
|
滴下量 Vt [min] |
22.82 |
23.60 |
24.21 |
25.03 |
|
Vt-V0 [min] |
0.00 |
0.78 |
1.39 |
2.21 |
これらの値から、サンプル5ml中に含まれる酢酸エチルの反応量[mol]を算出する。計算法は3-[1週目](ii)と同様の方法である。
t=0 ; 0.02472×(0.00)×10-3
=0.00 [mol]
t=10 ; 0.02472×(0.78)×10-3 =1.92816×10-5
=1.928×10-5 [mol]
t=20 ; 0.02472×(1.39)×10-3 =3.43608×10-5
=3.436×10-5 [mol]
t=30 ; 0.02472×(2.21)×10-3 =5.46312×10-5
=5.463×10-5 [mol]
こちらも有効数字が1桁多いように思えるかもしれないが、1週目の時と同じ理由で有効数字が4桁なのである。
また、反応した酢酸エチルの反応量の濃度C’t[mol/L]は、上記の計算で出した酢酸エチルの反応量[mol]が5ml中のものなので、1000/5=200をかければよい。計算結果は簡単に算出できるので、表9にまとめた。
表9 酢酸エチルの反応量(5ml)
|
時間 t [min] |
0 |
10 |
20 |
30 |
|
酢酸エチル反応量 [mol/5ml] |
0.000 |
1.928 ×10-5 |
3.436 ×10-5 |
5.463 ×10-5 |
|
酢酸エチル反応量 C’t [mol/L] |
0.000 |
3.856 ×10-3 |
6.872 ×10-3 |
1.092 ×10-2 |
反応した酢酸エチルの量がわかったので、反応せずに残っている酢酸エチルの量を算出できる。すなわち、残っている酢酸エチル濃度Ctを算出できる。Ctを算出できるので、ln (Ct/ C0)を算出できることになる。C0は酢酸エチルの初濃度である。
20℃での酢酸エチルの密度をd20=0.901とし、酢酸エチルの分子量を88.11とする。
C0 =5×0.901/88.11×1000/(80+20+5)=0.486945
=0.4869 [mol/L] (=48.69×10-2)
Ct =C0 -C’t = 0.4869 -C’t [mol/L]である。
t=0 ; C0=48.69×10-2 -0.00=0.4869 [mol/L]
t=10 ; C10=48.69×10-2 -0.3856×10-2=0.4830445
=0.4830 [mol/L]
t=20 ; C20=48.69×10-2 -0.6872×10-2=0.45034
=0.4503 [mol/L]
t=30 ; C30=48.69×10-2 -1.092×10-2=0.47598
=0.4760 [mol/L]
よって、C0と共にCtも求まったので、ln (Ct/ C0)を算出できる。
t=0 ; ln (C0/
C0)=ln(0.4869/0.4869)=定義外
t=10 ; ln (C10/
C0)=ln(0.4830/0.4869)=-0.007951903
=-0.007952
t=20 ; ln (C20/ C0)=ln(0.4503/0.4869)=-0.014215063
=-0.01422
t=30 ; ln (C30/
C0)=ln(0.4760/0.4869)=-0.02269668
=-0.02270
表10 酢酸エチルの反応量濃度と残量濃度(5ml)
|
時間 t [min] |
0 |
10 |
20 |
30 |
|
C't [mol/L] |
0.0000 |
0.01985 |
0.03656 |
0.05189 |
|
Ct [mol/L] |
0.4869 |
0.4671 |
0.4504 |
0.4351 |
|
Ln Ct/C0 |
ー |
-0.007952 |
-0.01422 |
-0.02270 |
(iii)2ml酢酸エチルでの時間ごとの酢酸エチルの反応量
t分後の滴定量Vt,t=0での滴定量V0をする。
時間ごとのNaOHaqの滴定量を示す値を示す。
表11 滴定量(2ml)
|
時間 t [min] |
0 |
10 |
20 |
30 |
|
ビュレットの値 前 |
0.00 |
0.00 |
0.00 |
0.00 |
|
後 |
22.78 |
22.99 |
23.30 |
23.60 |
|
滴下量 Vt [min] |
22.78 |
22.99 |
23.30 |
23.60 |
|
Vt-V0 [min] |
0.00 |
0.21 |
0.52 |
0.82 |
これらの値から、サンプル5ml中に含まれる酢酸エチルの反応量[mol]を算出する。計算法は3-[1週目](ii)と同様の方法である。
t=0 ; 0.02472×(0.00)×10-3
=0.00 [mol]
t=10 ; 0.02472×(0.21)×10-3 =5.1912×10-6
=5.192×10-6 [mol]
t=20 ; 0.02472×(0.52)×10-3 =1.28544×10-5
=1.285×10-5 [mol]
t=30 ; 0.02472×(0.82)×10-3 =2.02704×10-5
=2.027×10-5 [mol]
こちらも有効数字が1桁多いように思えるかもしれないが、1週目の時と同じ理由で有効数字が4桁なのである。
また、反応した酢酸エチルの反応量の濃度C’t[mol/L]は、上記の計算で出した酢酸エチルの反応量[mol]が5ml中のものなので、1000/5=200をかければよい。計算結果は簡単に算出できるので、表12にまとめた。
表12 酢酸エチルの反応量(2ml)
|
時間 t [min] |
0 |
10 |
20 |
30 |
|
酢酸エチル反応量 [mol/5ml] |
0.000 |
5.191 ×10-6 |
1.285 ×10-5 |
2.027 ×10-5 |
|
酢酸エチル反応量 C’t [mol/L] |
0.000 |
1.038 ×10-3 |
2.570 ×10-3 |
4.054 ×10-3 |
反応した酢酸エチルの量がわかったので、反応せずに残っている酢酸エチルの量を算出できる。すなわち、残っている酢酸エチル濃度Ctを算出できる。Ctを算出できるので、ln (Ct/ C0)を算出できることになる。C0は酢酸エチルの初濃度である。
20℃での酢酸エチルの密度をd20=0.901とし、酢酸エチルの分子量を88.11とする。
C0 =2×0.901/88.11×1000/(80+20+5)=0.194778
=0.1948 [mol/L] (=194.8×10-3)
Ct =C0 -C’t =0.1948 -C’t [mol/L]である。
t=0 ; C0=194.8×10-3 -0.00=0.1948 [mol/L]
t=10 ; C10=194.8×10-3 -1.038×10-3=0.19376
=0.1934 [mol/L]
t=20 ; C20=194.8×10-3 -2.570×10-3=0.19223
=0.1922 [mol/L]
t=30 ; C30=194.8×10-3-4.054×10-3=0.190746
=0.1907 [mol/L]
よって、C0と共にCtも求まったので、ln (Ct/ C0)を算出できる。
t=0 ; ln (C0/
C0)=ln(0.1948/0.1948)=定義外
t=10 ; ln (C10/
C0)=ln(0.1934/0.1948)=-0.005345279
=-0.005345
t=20 ; ln (C20/ C0)=ln(0.1922/0.1948)=-0.013288519
=-0.01329
t=30 ; ln (C30/
C0)=ln(0.1907/0.1948)=-0.021036072
=-0.02104
表13 酢酸エチルの反応量濃度と残量濃度(2ml)
|
時間 t [min] |
0 |
10 |
20 |
30 |
|
C't [mol/L] |
0.0000 |
0.00104 |
0.00257 |
0.00405 |
|
Ct [mol/L] |
0.1948 |
0.1934 |
0.1922 |
0.1907 |
|
Ln Ct/C0 |
ー |
-0.005345 |
-0.01329 |
-0.02104 |
(iv)7ml酢酸エチルでの時間ごとの酢酸エチルの反応量
t分後の滴定量Vt,t=0での滴定量V0をする。
時間ごとのNaOHaqの滴定量を示す値を示す。
表14 滴定量(7ml)
|
時間 t [min] |
0 |
10 |
20 |
30 |
|
ビュレットの値 前 |
0.00 |
0.00 |
0.00 |
0.00 |
|
後 |
22.82 |
23.77 |
24.74 |
25.81 |
|
滴下量 Vt [min] |
22.82 |
23.77 |
24.74 |
25.81 |
|
Vt-V0 [min] |
0.00 |
0.95 |
1.92 |
2.99 |
これらの値から、サンプル5ml中に含まれる酢酸エチルの反応量[mol]を算出する。計算法は3-[1週目](ii)と同様の方法である。
t=0 ; 0.02472×(0.00)×10-3
=0.00 [mol]
t=10 ; 0.02472×(0.95)×10-3 =2.3484×10-5
=2.348×10-6 [mol]
t=20 ; 0.02472×(1.92)×10-3 =4.74624×10-5
=4.746×10-5 [mol]
t=30 ; 0.02472×(2.99)×10-3 =7.31912×10-5
=7.391×10-5 [mol]
こちらも有効数字が1桁多いように思えるかもしれないが、1週目の時と同じ理由で有効数字が4桁なのである。
また、反応した酢酸エチルの反応量の濃度C’t[mol/L]は、上記の計算で出した酢酸エチルの反応量[mol]が5ml中のものなので、1000/5=200をかければよい。計算結果は簡単に算出できるので、表12にまとめた。
表15 酢酸エチルの反応量(7ml)
|
時間 t [min] |
0 |
10 |
20 |
30 |
|
酢酸エチル反応量 [mol/5ml] |
0.000 |
2.348 ×10-6 |
4.746 ×10-5 |
7.391 ×10-5 |
|
酢酸エチル反応量 C’t [mol/L] |
0.000 |
4.696 ×10-3 |
9.492 ×10-3 |
1.478 ×10-2 |
反応した酢酸エチルの量がわかったので、反応せずに残っている酢酸エチルの量を算出できる。すなわち、残っている酢酸エチル濃度Ctを算出できる。Ctを算出できるので、ln (Ct/ C0)を算出できることになる。C0は酢酸エチルの初濃度である。
20℃での酢酸エチルの密度をd20=0.901とし、酢酸エチルの分子量を88.11とする。
C0 =7×0.901/88.11×1000/(80+20+5)=0.681724
=0.6817 [mol/L] (=68.17×10-2)
Ct =C0 -C’t =0.1948 -C’t [mol/L]である。
t=0 ; C0=68.17×10-2 -0.00=0.6817 [mol/L]
t=10 ; C10=68.17×10-2 -0.1038×10-2=0.680662
=0.6807 [mol/L]
t=20 ; C20=68.17×10-2 -0.2570×10-2=0.67913
=0.6791 [mol/L]
t=30 ; C30=68.17×10-2 -1.478×10-2=0.66692
=0.6669 [mol/L]
よって、C0と共にCtも求まったので、ln (Ct/ C0)を算出できる。
t=0 ; ln (C0/
C0)=ln(0.6817/0.6817)=定義外
t=10 ; ln (C10/
C0)=ln(0.6807/0.6817)=-0.005345279
=-0.005345
t=20 ; ln (C20/ C0)=ln(0.6791/0.6817)=-0.013288519
=-0.01329
t=30 ; ln (C30/
C0)=ln(0.6669/0.6817)=-0.021036072
=-0.02104
表16 酢酸エチルの反応量濃度と残量濃度(7ml)
|
時間 t [min] |
0 |
10 |
20 |
30 |
|
C't [mol/L] |
0.0000 |
0.0470 |
0.00949 |
0.01478 |
|
Ct [mol/L] |
0.6817 |
0.6807 |
0.6791 |
0.6669 |
|
Ln Ct/C0 |
ー |
-0.005345 |
-0.01329 |
-0.02104 |
(iii)ここまで求めてきたものをまとめる。
表8、表11と表14より、表17を作成した。
表17 時間tとVt-V0
|
時間 t [min] |
0 |
10 |
20 |
30 |
|
|
Vt-V0 |
2ml |
0.00 |
0.21 |
0.52 |
0.82 |
|
|
5ml |
0.00 |
0.78 |
1.39 |
2.21 |
|
|
7ml |
0.00 |
0.95 |
1.92 |
2.99 |
表17より、図3を作成した
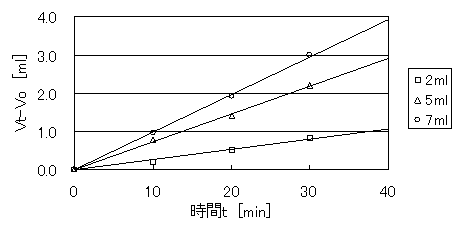
図3 時間tとVt-V0の関係
表9、表12と表15より、表18を作成した。
表18 時間tと生成した酢酸濃度
|
時間 t [min] |
0 |
10 |
20 |
30 |
|
|
C't ×103 |
2ml |
0.00 |
1.038 |
2.571 |
4.055 |
|
|
5ml |
0.00 |
3.857 |
6.873 |
10.93 |
|
|
7ml |
0.00 |
4.700 |
9.498 |
14.79 |
表18より、図4を作成した。
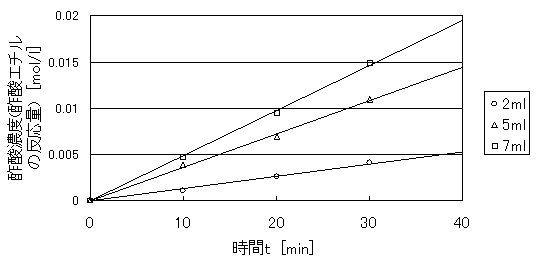
図4 時間tと生成した酢酸濃度 の関係
5.考察
(1)1週目の実験で予想されるV0の値は何[ml]か?
滴定に要した時間と、運搬に要した時間が無視できるとする。そうすると、酢酸は精製されず、V0は正味塩酸の中和に要した水酸化ナトリウムの滴定量ということになる。だだし、塩酸の濃度は2[mol/L]とし、水酸化ナトリウムの濃度を0.09927[mol/L]とする。よって、
2×20/(80+20+5)×5×10-3=0.09827×V0×10-3
V0=2×20/(80+20+5)×5/0.09827
=19.3829
=19.38 [ml]
(2)1週目の実験で、酢酸エチルがすべて反応すると水酸化ナトリウム水溶液は何[ml]必要か?だたし、水酸化ナトリウムの濃度は0.09927[mol/L]とし、酢酸エチルの密度は0.901[g/mlとし、分子量は88.11[g/mol]とする。
酢酸エチルの加水分解反応の逆反応が起きない、負可逆反応だとする。
必要な水酸化ナトリウム水溶液の量をV[ml]すると、
5×0.901/88.11=0.09827×V×10-3
V=5×0.901/88.11/0.09827×103
=52.0293
=52.03 [ml]
(3)1週目の実験で算出した活性化エネルギーを用いて、0~100℃のk’を求めよ。また、そのグラフを作成せよ。さらに、0℃のk’を使って、0℃における滴定時間内(5分)の反応量を算出し、25℃における結果に対してどの程度影響しているか?
3-[1週目](iv)より、酢酸エチルの加水分解反応の産出した活性化エネルギーEaは=5.91×104 [J]であった。(10)式のArrheniusの式のA(頻度因子)をまず求める。
A=k’/exp(-Ea/RT)
k’はすでに求まっているので、k’25=0.00353とk’25=0.00772の時の平均を用いることにする。
A={k’25/ exp(-Ea/RT)+k’35/exp(-Ea/RT)}/2
={0.00353/exp(5.91×104 /R(273.14+25.0))
+0.00772/exp(5.91×104 /R(273.14+35.1))}/2
=7.98422×107
=7.984×107
また、k’=A exp(-Ea/RT)なので、ここに求めていくと、
0℃; k’=A exp(-Ea/273R)=0.00039316=0.0003931
10℃; k’=A exp(-Ea/283R)=0.00098658=0.0009866
20℃; k’=A exp(-Ea/293R)=0.00232499=0.02325
30℃; k’=A exp(-Ea/303R)=0.00517770=0.005178
40℃; k’=A exp(-Ea/313R)=0.01095558=0.01096
50℃; k’=A exp(-Ea/323R)=0.02212987=0.02213
60℃; k’=A exp(-Ea/333R)=0.04285322=0.04285
70℃; k’=A exp(-Ea/343R)=0.07984600=0.07984
80℃; k’=A exp(-Ea/353R)=0.14361840=0.1436
90℃; k’=A exp(-Ea/363R)=0.25010352=0.2501
100℃; k’=A exp(-Ea/373R)=0.42277774=0.4228
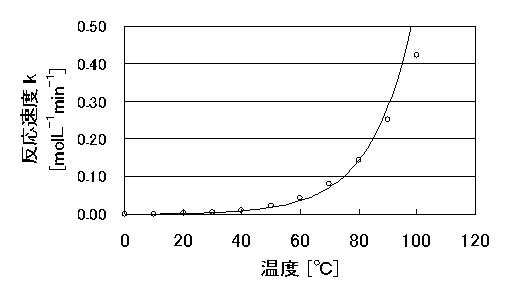
図5 反応速度kと温度[℃]
上記の値より、0℃5分間で進む反応量は
k’×5=0.00039316×5=0.001966
よって、1.966×10-3[mol/L]分だけ水酸化ナトリウムの滴定量が増えることになる。
1.966×10-3×5×10-3=0.09827×v×10-3
v=1.00030×10-4=1.000×10-4 [ml]
1.000×10-4 [ml]分だけ増える。これはビュレットでは読み取れない値なので、実験ではの殆ど誤差としては現れない。
また、25℃ではk’25=0.00353である。
k’25×5=0.00353×5=0.01765=0.0177 [mol/L]
0.0177×5×10-3=0.09827×v×10-3
v=0.900580=0.901 [ml]
0.901 [ml] 分だけ増える。これはビュレットで明らかに読み取れる値なので、実験では大きな誤差として現れる。
6.課題
1週目の実験において、酢酸エチルの加水分解反応が2次であると仮定して、速度式を立てよ。2日目の場合を1次の時と同様にグラフを作成せよ。また、違いを考察せよ。
単に、A + B → 生成物 と進む反応を考える。反応速度rは
r=kCACB=kCA2=kCB2
と書ける。Aを酢酸エチル,Bを水をする。
![]() ・・・*
・・・*
と記述できる。
また、水の濃度は水の密度を1[g/ml]とすると、
[H20]=80×1/18.0×1000/(80+20+5)=42.328=42.33 [mol/L]
さらに、*式を積分すると
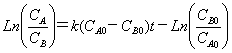
また、変換することが出来る。ただし、CA0はCAの初期濃度、CB0はCBの初期濃度である。CAは酢酸エチル濃度で、CBは水の濃度である。
よって、Ln (CA/CB)が時間に対して直線関係を示せばよい。
表19 2次反応
|
時間 t [min] |
0 |
10 |
20 |
30 |
50 |
70 |
90 |
|
CA |
0.4869 |
0.4415 |
0.4099 |
0.3792 |
0.3238 |
0.2772 |
0.2391 |
|
CB |
42.33 |
42.33 |
42.28 |
42.25 |
42.22 |
42.17 |
42.12 |
|
Ln CA/CB |
-4.465 |
-4.563 |
-4.636 |
-4.713 |
-4.871 |
-5.025 |
-5.171 |
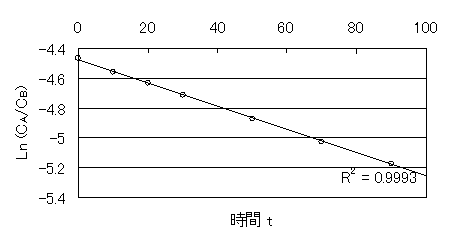
図6 2次反応式のグラフ
6.参考文献
化学実験テキスト研究会編:図解・化学実験シリーズ1 基礎化学実験、産業図書
P.W.アトキンス著:第六版 物理化学(下)、東京化学同人
津田栄著:改訂新版 化学通論、朝倉書店
玉虫文一ら著:第3版増補版 理化学事典、岩波書店
日本化学会編:改訂5編 化学便覧 基礎化学編 Ⅱ、丸善
M.ブダー著 大島榮次訳:化学技術者のための反応速度論、丸善
東京工業大学化学実験室編:新版 基礎化学実験、講談社サイエンティフィック