1.目的
酢酸水溶液に多孔質の吸着剤を入れると、吸着剤が酢酸分子を吸着する。吸着平衡状態を再現し、そのときの酢酸濃度と吸着剤1g当りに吸着された酢酸の量には関係がある。古くから使われている実験式である、フロインドリッヒの等温吸着式を用いて結果を整理し、それぞれの吸着剤の吸着能力について考える。
2.実験方法
[1日目]
(i)約10M水酸化ナトリウム溶液を10ml量りとり、1Lのポリビンに移してイオン交換水で約0.1Mに希釈する。ファクター(f=1.080)の0.1M フタル酸水素カリウム(KHP)溶液で約0.1Mに調製した水酸化ナトリウム溶液の濃度を標定する。被滴下のフタル酸水素カリウム溶液はホールピペットを用い、10mlをコニカルビーカーに入れ滴定する。これを2回以上行い、平均値を用いて水酸化ナトリウム濃度を決定する。
(ii)酢酸を6ml量りとり、500mlのポリビンに移して、イオン交換水を加えてポリビンの目盛りで400mlする。これで約0.25Mの酢酸水溶液になる。ここで調製した約0.25Mの酢酸溶液を200mlメスシリンダーで100mlとり、イオン交換水を加えて200mlして1/8Mの溶液を調製する。同様の操作を繰り返して、1/16M、1/32M、1/64Mの酢酸溶液を各100ml調製し、250mlポリビンに貯蔵する。
(iii)1/4〜1/64Mの各酢酸水溶液の初濃度C1を、(i)で標定した水酸化ナトリウム溶液で決定する。
(iv) 三角フラスコ5個にそれぞれ1/4〜1/64Mの酢酸溶液50mlをホールピペットで分取する。活性炭を正確に0.50g秤量し、各三角フラスコに入れ、ふたをして軽く振り混ぜる。活性炭を入れた時間をt=0として、30分間静置するが5分おきに軽く振り混ぜる。
(v)30分経過したら、乾いた濾紙で濾過をする。この時、濾液を別の三角フラスコに取る。濾液を10mlホールピペットで量りとり、(i)で標定した水酸化ナトリウム溶液で滴定して酢酸の濃度C2を決定する。この際、各濃度で2回以上滴定をし平均を結果に用いる。
[2日目]
2日目は、1日目と実験操作は同様であるが、1日目に標定した水酸化ナトリウム溶液があるので(i)の操作を行わない。
また、(iv)で酢酸溶液中に入れる吸着剤を活性炭からゼネオライトに替えて実験を行う。
3.実験原理
ここでは滴定については説明を行わず、結果の整理で必要になるフロインドリッヒの等温吸着式について記述する。
フロインドリッヒの等温吸着式は、溶液中の分子が固体表面に吸着するに多くの場合一致する実験式である。
この実験式は吸着剤と吸着平衡にある濃度をC、1gの吸着剤に吸着された溶質のグラム数をXとしたとき、溶液濃度があまり濃くない場合に、CとXの間に見出された実験式である。
X =A・Cn
(1)
ただし、Aおよびnは定数であって、1つの溶質および吸着剤を用いれば一定温度において一定の値をとる。
フロインドリッヒの等温吸着式 (1)の両辺の対数をとると、次式がえられる。
log X = log A +n log C (2)
実験結果を上式(2)に代入しグラフを作成することにより、傾きn、切片log Aを求めることが出来る。傾きnは吸着指数(n<1)といい、通常0.2 〜1の間にある。切片log Aは、C =1[mol / L]時の吸着剤1[g]当り吸着量[g]である。
また吸着量Xは濃度Cに比例しておらず、濃度がr倍(r>1)になっても、吸着はr倍にならない。すなわち、濃度が薄いときの方が吸着される割合が大きくなる。
比例定数であるAが大きいほど、吸着剤の吸着力が高いということになる。
4.結果とまとめ
(1)各日に得られたデータから水酸化ナトリウム・酢酸の濃度を求める。
[1日目]
(i)0.1[mol/L] NaOHaqの標定
0.1[mol/L] KHPaqのfactor f=1.080
0.1[mol/L] NaOHaqの滴定量
1回目 10.02 [ml]
2回目 10.03 [ml]
0.1[mol/L] NaOHaqの濃度をCとすると
0.1 ×1.080 ×(10.02+10.03) /2 =C ×10
∴ C =0.10827
=0.1083 [mol/L]
0.1[mol/L] NaOHaqのfactor
f=0.1083 /0.1000 =1.080
(ii)吸着前の1/4,1/8,1/16,1/32,1/64[mol/L]の酢酸濃度C1
各濃度のNaOHaqの滴定量
|
目安濃度[mol/L] |
1/4 |
1/8 |
1/16 |
1/32 |
1/64 |
|
1回目 |
26.70 |
○ 13.12 |
○ 6.51 |
○ 3.37 |
1.63 |
|
2回目 |
26.72 |
○ 13.19 |
6.59 |
3.31 |
1.67 |
|
3回目 |
|
○ 13.15 |
○ 6.51 |
○ 3.38 |
|
|
|
|
|
|
|
|
|
3回滴定したものについては、○が付いている値を平均値の算出に用いる |
|||||
注)1/8Mの酢酸溶濃度決めるためNaOHaqで3回滴定を行った。酢酸濃度を決定する際の計算で滴定3回のすべての値を使う理由は、滴定終点でのフェノールフタレインの着色した色がほぼ同じ色で極めて薄い色であったためである。さらに、13.15mlを中心として他のNaOHaqの滴下量がほぼ等間隔あり、その誤差が0.07mlと小さい値のため滴定して得られた3つの値すべてを使う。
1/4 M ; 0.1083 ×(26.70+26.72) /2 =C1×10
∴ C1=0.28926
=0.2893
=2.893×10-1 [mol/L]
1/8 M ; 0.1083 ×(13.12+13.19+13.15) /3 =C1×10
∴ C1=0.14245
=0.1425
=1.425×10-1 [mol/L]
1/16 M; 0.1083 ×(6.51+6.51) /2 =C1×10
∴ C1=0.070503
=0.0705
=7.05×10-2 [mol/L]
1/32 M; 0.1083 ×(3.37+3.38) /2 =C1×10
∴ C1=0.036551
=0.0366
=3.65×10-2 [mol/L]
1/64 M; 0.1083 ×(1.63+1.67) /2 =C1×10
∴ C1=0.017869
=0.0179
=1.79×10-2 [mol/L]
(iii)活性炭の秤量
各濃度1/4,1/8,1/16,1/32,1/64[mol/L]の酢酸溶液が入った三角フラスコに、0.50gを正確に秤量した活性炭を入れた。
(iv) 吸着後の1/4,1/8,1/16,1/32,1/64[mol/L]の酢酸濃度C2
各濃度のNaOHaqの滴定量
|
目安濃度[mol/L] |
1/4 |
1/8 |
1/16 |
1/32 |
1/64 |
|
1回目 |
23.99 |
11.30 |
5.39 |
2.57 |
1.18 |
|
2回目 |
23.96 |
11.28 |
○ 5.25 |
2.50 |
1.21 |
|
3回目 |
|
|
○ 5.24 |
|
|
|
|
|
|
|
|
|
|
3回滴定したものについては、○が付いている値を平均値の算出に用いる |
|||||
1/4 M ; 0.1083 ×(23.99+23.96) /2 =C2×10
∴ C2=0.25964
=0.2596
=2.596×10-1 [mol/L]
1/8 M ; 0.1083 ×(11.30+11.28) /2 =C2×10
∴ C2=0.12227
=0.1223
=1.223×10-1 [mol/L]
1/16 M; 0.1083 ×(5.25+5.24) /2 =C2×10
∴ C2=0.056803
=0.0568
=5.68×10-2 [mol/L]
1/32 M; 0.1083 ×(2.53+2.50) /2 =C2×10
∴ C2=0.027237
=0.0272
=2.72×10-2 [mol/L]
1/64 M; 0.1083 ×(1.18+1.21) /2 =C2×10
∴ C2=0.012941
=0.0129
=1.29×10-2 [mol/L]
[2日目]
(i)吸着前の1/4,1/8,1/16,1/32,1/64[mol/L]の酢酸濃度C1
各濃度のNaOHaqの滴定量
|
目安濃度[mol/L] |
1/4 |
1/8 |
1/16 |
1/32 |
1/64 |
|
1回目 |
26.73 |
13.23 |
6.71 |
3.66 |
1.88 |
|
2回目 |
26.75 |
13.20 |
6.70 |
3.67 |
○ 1.82 |
|
3回目 |
|
|
|
|
○ 1.79 |
|
|
|
|
|
|
|
|
3回滴定したものについては、○が付いている値を平均値の算出に用いる |
|||||
1/4 M ; 0.1083 ×(26.73+26.75) /2 =C1×10
∴ C1=0.28959
=0.2896
=2.986×10-1 [mol/L]
1/8 M ; 0.1083 ×(13.23+13.20) /2 =C1×10
∴ C1=0.14311
=0.1431
=1.431×10-1 [mol/L]
1/16 M; 0.1083 ×(6.71+6.70) /2 =C1×10
∴ C1=0.072645
=0.0726
=7.26×10-2 [mol/L]
1/32 M; 0.1083 ×(3.66+3.67) /2 =C1×10
∴ C1=0.039691
=0.0397
=3.97×10-2 [mol/L]
1/64 M; 0.1083 ×(1.82+1.79) /2 =C1×10
∴ C1=0.019548
=0.0195
=1.95×10-2 [mol/L]
(ii)ゼネオライトの秤量
各濃度1/4,1/8,1/16,1/32,1/64[mol/L]の酢酸溶液が入った三角フラスコに、0.50gを正確に秤量したゼネオライトを入れた。
(iii) 吸着後の1/4,1/8,1/16,1/32,1/64[mol/L]の酢酸濃度C2
各濃度のNaOHaqの滴定量
|
目安濃度[mol/L] |
1/4 |
1/8 |
1/16 |
1/32 |
1/64 |
|
1回目 |
25.13 |
12.01 |
5.91 |
3.66 |
1.51 |
|
2回目 |
25.11 |
12.04 |
5.93 |
3.67 |
1.53 |
|
3回目 |
|
|
|
|
○ 1.44 |
|
4回目 |
|
|
|
|
○ 1.49 |
|
4回滴定したものについては、○が付いている値を平均値の算出に用いる |
|||||
注)1/64Mの滴定で1・2回目のときは、NaOHaqを多く滴下し過ぎて、フェノールフタレインが濃い赤紫色に発色してしまった。よって、滴定の終点でフェノールフタレインがうすい赤紫色になるまで滴定を行った。その滴定の結果は3・4回目であった。
1/4 M ; 0.1083 ×(25.13+25.11) /2 =C2×10
∴ C2=0.27204
=0.2720
=2.720×10-1 [mol/L]
1/8 M ; 0.1083 ×(12.01+12.04) /2 =C2×10
∴ C2=0.13023
=0.1302
=1.302×10-1 [mol/L]
1/16 M; 0.1083 ×(5.91+5.93) /2 =C2×10
∴ C2=0.064113
=0.0641
=6.41×10-2 [mol/L]
1/32 M; 0.1083 ×(3.10+3.07) /2 =C2×10
∴ C2=0.033410
=0.0334
=3.34×10-2 [mol/L]
1/64 M; 0.1083 ×(1.44+1.49) /2 =C2×10
∴ C2=0.015865
=0.0159
=1.59×10-2 [mol/L]
(2)上記の結果を基にして、フロンドリッヒの等温吸着式に必要な因子についての計算を行い、求めた値を表にまとめた。
表1 活性炭0.50[g]の酢酸の吸着
|
|
|
|
|
|
|
|
|
酢酸の濃度 |
目安 [mol/L] |
1/4 |
1/8 |
1/16 |
1/32 |
1/64 |
|
実際の濃度C1×10-2 (吸着前) |
28.93 |
14.25 |
7.050 |
3.655 |
1.787 |
|
|
C2×10-2 (吸着後) |
25.96 |
12.17 |
5.680 |
2.724 |
1.294 |
|
|
酢酸の吸着全量 X [10-2g] |
8.901 |
5.926 |
4.117 |
2.799 |
1.481 |
|
|
吸着剤1g当りの吸着量 Y
[10-2g] |
17.82 |
11.85 |
8.234 |
5.598 |
2.962 |
|
|
log C2 |
-0.5856 |
-0.9110 |
-1.245 |
-1.565 |
-1.888 |
|
|
log Y |
-0.7495 |
-0.9262 |
-1.084 |
-1.252 |
-1.529 |
|
|
|
|
|
|
|
|
|
|
表2 ゼネオライト0.50[g]の酢酸の吸着 |
||||||
|
|
|
|
|
|
|
|
|
酢酸の濃度 |
目安 [mol/L] |
1/4 |
1/8 |
1/16 |
1/32 |
1/64 |
|
実際の濃度C1×10-2 (吸着前) |
28.96 |
14.31 |
7.264 |
3.969 |
1.955 |
|
|
C2×10-2 (吸着後) |
27.20 |
13.02 |
6.411 |
3.341 |
1.587 |
|
|
酢酸の吸着全量 X [10-2g] |
5.274 |
3.870 |
2.562 |
1.887 |
1.107 |
|
|
吸着剤1g当りの吸着量 Y
[10-2g] |
10.55 |
7.741 |
5.125 |
3.774 |
2.213 |
|
|
log C2 |
-0.5654 |
-0.8853 |
-1.193 |
-1.476 |
-1.800 |
|
|
log Y |
-0.9768 |
-1.111 |
-1.290 |
-1.423 |
-1.655 |
|
注)本来、吸着剤の量の有効数字は2桁であるが、上記の2つの表のY、log Yの有効数字は4桁にしてある。その理由は有効数字を2桁にするとグラフを作成する際に、上記の2つの表のlog Yを用いるため、グラフから切片log A、 傾きnを求める際に大きな誤差が出来てしまうためである。
(3)表1と表2の値を基にして、実験原理で示した式(2)に代入してグラフを作成した。
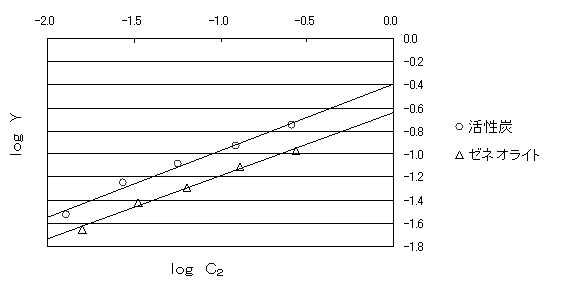
図1 吸着剤による酢酸の吸着
図1を書いた事により、直線の式を求めることが出来る。そのことにより、切片からlog A、 傾きからnを求めることが出来る。
活性炭 log X = 0.5777 log Y + log 0.4052
ゼネオライト log X = 0.5454 log Y + log 0.2262
よって、活性炭・ゼネオライトのlog Aおよびnは、
活性炭 log A =0.5777 n=0.4052
ゼネオライト log A =0.5454 n=0.2262
である。
また、平均二乗誤差R2は、活性炭がR2=0.9855で、ゼネオライトがR2=0.9915であった。
フロインドリッヒの等温吸着式の原形の式(1)に、今回の実験で求めることが出来た吸着定数nと、比例定数Aを代入して作成した関数と実験で得た値との関係を下記の図に示した。
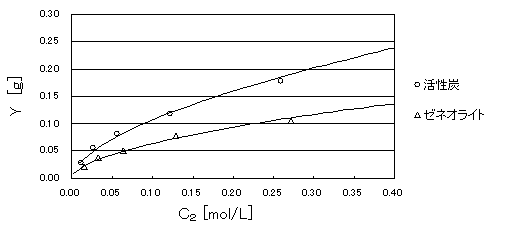
図2 測定値と導き出した実験式との関係
5.考察
0.1M NaOHaqの標定ために行った滴定では、終点でのフェノールフタレインの各回での変色がうすい赤紫色になったことから、NaOHの濃度の誤差は非常に小さいと考えられる。また1日目に行った酢酸濃度を決める滴定では、2回の滴定で規定の滴定量の誤差範囲に入らなかった事も多かった。2日目に行った酢酸濃度を決める滴定では滴定操作に慣れてきたため、ほとんど2回で滴定量が規定の誤差範囲内に納まった。この時、フェノールフタレインの変色が濃く、滴定をやり直したは1/64Mの酢酸溶液で、酢酸濃度が最も薄いため滴下量の調節が難しかったためである。
図1を見てもわかるように、吸着剤が活性炭、ゼネオライトどちらもほぼ実験値が直線の関係を示している。また、活性炭とゼネオライトの近似直線の平均二乗誤差R2はそれぞれR2=0.9855、R2=0.9915であった。この値が1.000に極めて近いことからもlog Xとlog Yが比例関係であると言える。
図1から求めた定数Aとnを用いて、各吸着剤についてフロイントリッヒの吸着式に代入して作成した図2でも、実験値との少ない。
吸着剤がゼネオライトの方が活性炭よりも、フロインドリッヒの吸着式に近いのかを考えた。まず考えられることは、実験のテクニックが1日目より向上したため測定誤差が少なくなった事である。さらにゼネオライトの粒は一様の形であったが、活性炭は顆粒であったため形がまばらであった。そのため、活性炭のグラム数が表面積に比例しておらず、吸着量の誤差として出た。もう1つ挙げられる原因としては、活性炭の比重が軽いたに活性炭の顆粒が酢酸溶液に数個浮いてしまってたり、三角フラスコの内壁にくっ付いてしまったことである。このために吸着平衡が起こらなくなってしまった。
6.課題(ラングミュラの等温吸着式について)
ラングミュラの等温吸着式は、気体表面に吸着された分子が1分子の厚さ、すなわち単分子層であるとして導かれたものである。
固体が一定温度で気体を吸着する場合、固体表面の単位面積に吸着される量をxと気相の圧力pと関係は次の式で示される。
![]() (3)
(3)
a,bは実験で一致するように定められた定数で、固体と気体とによって決まる。非常に吸着されやすい気体の場合にはbが大きく、気体の圧力が大きい場合にはpが大きい。どちらの場合も、式(3)の分母の1はbpに比べて小さいので省略してもよいので、式(3)は次のようになる。
x=a (4)
すなわち、この場合には吸着量が気体の圧力に無関係で、固体の表面が吸着物質で飽和されていることになる。
7.感想
この実験は高校時代にもやったことがある実験であったが、実験誤差としては今回の実験の方が小さく出た。その原因としては、高校時代に行ったときの酢酸濃度が今回のものより約1.5倍であったため、誤差が大きかったんだと思う。
今回の実験は、大学で始めて行う本格的な化学実験だったのではじめは少し力んでしまった。実験操作もすばやく行えるようになりいい経験になった。今回の実験の経験を踏まえ、今後の実験に生かして生きたい。
8.参考文献
化学実験テキスト研究会編:図解・化学実験シリーズ1 基礎化学実験、産業図書
P.W.アトキンス著:第六版 物理化学(下)、東京化学同人
津田栄著:改訂新版 化学通論、朝倉書店
玉虫文一ら著:第3版増補版 理化学事典、岩波書店